Pijn is een zeer belangrijke functie van het menselijk lichaam, inclusief de betrokkenheid van nociceptoren en het centrale zenuwstelsel, of CNS, om berichten van schadelijke stimulatie naar de hersenen over te brengen. Nociceptoren zijn bijnieren die verantwoordelijk zijn voor het detecteren van gevaarlijke of schadelijke stimuli en voor het overbrengen van elektrische signalen naar het zenuwstelsel. De receptoren zijn aanwezig in huid, ingewanden, spieren, gewrichten en hersenvliezen om een reeks stimuli te ontdekken, die mechanisch, thermisch of chemisch kunnen zijn.
Er zijn twee soorten nociceptoren:
- C-vezels zijn het meest voorkomende type en zijn traag in het uitvoeren en reageren op stimuli. Zoals de eiwitten in het membraan van de receptor de stimulatie omzetten in elektrische impulsen die door het zenuwstelsel kunnen worden genomen.
- Het is bekend dat A-delta vezels sneller geleiden en boodschappen overbrengen van scherpe, kortstondige pijn.
Bovendien zijn er stille nociceptoren die meestal beperkt zijn tot stimuli maar kunnen worden "gewekt" met mechanische stimulatie met hoge intensiteit in reactie op chemische bemiddelaars uit het lichaam. Nociceptoren kunnen veel verschillende spanningsafhankelijke stations hebben voor transductie die een reeks actiepotentialen veroorzaken om de elektrische signalering naar het zenuwstelsel te starten. De prikkelbaarheid en het gedrag van de cel zijn gebaseerd op de soorten kanalen binnen de nociceptor.
Het is belangrijk om onderscheid te maken tussen nociceptie en pijn bij het beschouwen van het mechanisme van de pijn. Nociceptie is de normale reactie van het lichaam op schadelijke prikkels, waaronder reflexen onder de suprathreshold die het menselijk lichaam beschermen tegen verwonding. Pijn wordt alleen waargenomen wanneer superdrempel voor die nociceptoren om een mogelijke actie te bereiken en de pijnroute wordt geïnitieerd die relatief hoog is. Het doel van het onderstaande artikel is om de cellulaire en moleculaire mechanismen van pijn aan te tonen, waaronder acute pijn en chronische pijn, of aanhoudende pijn, zoals hieronder wordt vermeld.
Inhoudsopgave
Cellulaire en moleculaire pijnmechanismen
Abstract
Het zenuwstelsel detecteert en interpreteert een breed scala aan thermische en mechanische stimuli, evenals milieu- en endogene chemische irriterende stoffen. Wanneer ze intens zijn, genereren deze stimuli acute pijn en bij het vaststellen van aanhoudende schade vertonen zowel componenten van het perifere als het centrale zenuwstelsel van de pijntransmissieweg een enorme plasticiteit, verbeteren ze pijnsignalen en produceren ze overgevoeligheid. Wanneer plasticiteit beschermende reflexen mogelijk maakt, kan het gunstig zijn, maar als de veranderingen aanhouden, kan dit leiden tot een chronische pijnaandoening. Genetische, elektrofysiologische en farmacologische studies lichten de moleculaire mechanismen toe die ten grondslag liggen aan detectie, codering en modulatie van schadelijke stimuli die pijn veroorzaken.
Inleiding: Acute versus persistente pijn
Het vermogen om schadelijke stimuli te detecteren is essentieel voor het overleven en het welzijn van een organisme. Dit wordt dramatisch geïllustreerd door onderzoek van personen die lijden aan aangeboren afwijkingen waardoor ze niet in staat zijn om pijnlijke stimuli te detecteren. Deze mensen kunnen geen doordringende pijn voelen van een scherp voorwerp, een hitte van een open vlam of zelfs een ongemak in verband met interne verwondingen, zoals een gebroken bot. Als gevolg hiervan nemen ze geen passend beschermend gedrag aan tegen deze aandoeningen, waarvan er vele levensbedreigend kunnen zijn.
Meer algemeen leiden veranderingen van de pijnweg tot overgevoeligheid, zodanig dat pijn de bruikbaarheid ervan als een acuut waarschuwingssysteem overleeft en in plaats daarvan chronisch en slopend wordt. Dit kan op een bepaald niveau worden gezien als een verlenging van het normale genezingsproces, waarbij weefsel- of zenuwbeschadiging hyperactiviteit uitlokt om de bewaking van het geblesseerde gebied te bevorderen. Zonnebrand veroorzaakt bijvoorbeeld tijdelijke sensibilisatie van het getroffen gebied. Dientengevolge worden normaal onschadelijke stimuli, zoals lichte aanraking of warmte, als pijnlijk ervaren (een fenomeen dat wordt aangeduid als allodynie), of normaal veroorzaken pijnlijke stimuli pijn van grotere intensiteit (aangeduid als hyperalgesie). In het uiterste geval lost de sensitisatie niet op. Inderdaad, individuen die lijden aan artritis, post-herpetische neuralgie (na een aanval van gordelroos), of botkanker, ervaren intense en vaak niet aflatende pijn die niet alleen fysiologisch en psychologisch verzwakkend is, maar ook herstel kan belemmeren. Chronische pijn kan zelfs aanhouden lang na een acuut letsel, misschien het meest vaak ervaren als lage rugpijn of ischias.
Aanhoudende of chronische pijnsyndromen kunnen worden geïnitieerd of gehandhaafd op perifere en / of centrale loci. In beide gevallen is de opheldering van moleculen en celtypen die ten grondslag liggen aan normale (acute) pijnsensatie de sleutel tot het begrip van de mechanismen die ten grondslag liggen aan pijnovergevoeligheid. In de huidige review belichten we de moleculaire complexiteit van de primaire afferente zenuwvezels die schadelijke stimuli detecteren. We vatten niet alleen de verwerking van acute pijn samen, maar beschrijven ook hoe veranderingen in pijnverwerking optreden in de setting van weefsel- of zenuwbeschadiging.
De grote verschillen tussen acute en chronische pijn benadrukken het feit dat pijn niet wordt veroorzaakt door een onveranderlijk, hard bedraad systeem, maar eerder door de betrokkenheid van zeer plastische moleculen en circuits, waarvan de moleculair-biochemische en neuroanatomische basis het brandpunt is. huidige studies. Belangrijk is dat deze nieuwe informatie een groot aantal potentiële therapeutische doelen voor de behandeling van pijn heeft geïdentificeerd. We concentreren ons hier op de perifere en tweede orde neuronen in het ruggenmerg; de lezer wordt verwezen naar enkele uitstekende recensies van supraspinale pijnverwerkingsmechanismen, waaronder opmerkelijke inzichten die door beeldvormende onderzoeken naar het veld zijn gebracht (Apkarian et al., 2005).
Anatomisch overzicht
Nociceptie is het proces waarbij intense thermische, mechanische of chemische stimuli worden gedetecteerd door een subpopulatie van perifere zenuwvezels, nociceptoren genaamd (Basbaum en Jessell, 2000). De cellichamen van nociceptoren bevinden zich in de dorsale wortelganglia (DRG) voor het lichaam en het trigeminusganglion voor het gezicht, en hebben zowel een perifere als centrale axonale tak die respectievelijk hun doelorgaan en het ruggenmerg innerveert. Nociceptoren worden alleen opgewonden wanneer de stimulusintensiteiten het schadelijke bereik bereiken, wat suggereert dat ze biofysische en moleculaire eigenschappen bezitten die hen in staat stellen om selectief potentieel schadelijke stimuli te detecteren en erop te reageren. Er zijn twee hoofdklassen van nociceptoren. De eerste omvat gemyeliniseerde (A?) afferenten met een gemiddelde diameter die acute, goed gelokaliseerde "eerste" of snelle pijn mediëren. Deze gemyeliniseerde afferenten verschillen aanzienlijk van de grotere diameter en snel geleidende A? vezels die reageren op onschadelijke mechanische stimulatie (dwz lichte aanraking). De tweede klasse van nociceptoren omvat niet-gemyeliniseerde "C"-vezels met een kleine diameter die slecht gelokaliseerde, "tweede" of langzame pijn overbrengen.
Elektrofysiologische studies hebben A? verder onderverdeeld. nociceptoren in twee hoofdklassen. Type I (HTM: hoge drempel mechanische nociceptoren) reageren op zowel mechanische als chemische prikkels, maar hebben relatief hoge warmtedrempels (>50C). Als de warmtestimulus echter wordt gehandhaafd, zullen deze afferenten reageren bij lagere temperaturen. En het belangrijkste is dat ze sensibiliseren (dwz de hitte of mechanische drempel zal dalen) bij weefselbeschadiging. Type II A? nociceptoren hebben een veel lagere warmtedrempel, maar een zeer hoge mechanische drempel. De activiteit van deze afferente medieert vrijwel zeker de "eerste" acute pijnreactie op schadelijke hitte. Inderdaad, compressieblokkering van gemyeliniseerde perifere zenuwvezels elimineert de eerste, maar niet de tweede pijn. Daarentegen bemiddelt de Type I-vezel waarschijnlijk de eerste pijn die wordt veroorzaakt door speldenprikken en andere intense mechanische stimuli.
De niet-gemyeliniseerde C-vezels zijn ook heterogeen. Net als de gemyeliniseerde afferenten zijn de meeste C-vezels polymodaal, dat wil zeggen dat ze een populatie omvatten die zowel warmte- als mechanisch gevoelig is (CMH's) (Perl, 2007). Van bijzonder belang zijn de warmte reagerende, maar mechanisch ongevoelige niet-gemyeliniseerde afferenten (zogenaamde stille nociceptoren) die alleen mechanische gevoeligheid ontwikkelen in het kader van letsel (Schmidt et al., 1995). Deze afferenten reageren beter op chemische stimuli (capsaïcine of histamine) in vergelijking met de CMH's en spelen waarschijnlijk een rol wanneer het chemische milieu van ontsteking hun eigenschappen verandert. Deeltjes van deze afferenten reageren ook op een verscheidenheid aan jeuk producerende jeukende stoffen. Het is vermeldenswaard dat niet alle C-vezels nociceptoren zijn. Sommigen reageren op verkoeling, en een bijzonder interessante populatie van niet-gemyeliniseerde afferenten reageert op een onschadelijk strelen van de harige huid, maar niet op warmte of chemische stimulatie. Deze laatste vezels blijken een aangename aanraking te bemiddelen (Olausson et al., 2008).
Neuroanatomische en moleculaire karakterisering van nociceptoren heeft hun heterogeniteit verder aangetoond, met name voor de C-vezels (Snider en McMahon, 1998). De zogenaamde 'peptiderge' populatie van C-nociceptoren maakt bijvoorbeeld de neuropeptiden, stof P en calcitonine-gen-gerelateerd peptide (CGRP) vrij; ze brengen ook de TrkA-neurotrofine-receptor tot expressie, die reageert op zenuwgroeifactor (NGF). De niet-peptiderge populatie van C-nociceptoren brengt de c-Ret-neurotrofine-receptor tot expressie die het doelwit is van gliale neurotrofe factor (GDNF), evenals neurturine en artemine. Een groot percentage van de c-Ret-positieve populatie bindt ook aan het IB4-isolectine en brengt G-eiwit-gekoppelde receptoren van de Mrg-familie tot expressie (Dong et al., 2001), evenals specifieke purinerge receptorsubtypes, met name P2X3. Nociceptoren kunnen ook worden onderscheiden op basis van hun differentiële expressie van kanalen die gevoeligheid voor warmte (TRPV1), koude (TRPM8), zuur milieu (ASIC's) en een groot aantal chemische irriterende stoffen (TRPA1) verlenen (Julius en Basbaum, 2001). Zoals hieronder vermeld, associëren deze functioneel en moleculair heterogene klassen van nociceptoren zich met een specifieke functie bij de detectie van verschillende pijnmodaliteiten.
De nociceptor: een bidirectionele signaleringsmachine
Men denkt in het algemeen aan de nociceptor als het dragen van informatie in één richting, het verzenden van schadelijke stimuli van de periferie naar het ruggenmerg. Primaire afferente vezels hebben echter een unieke morfologie, pseudo-unipolair genoemd, waarbij zowel centrale als perifere terminals uit een gemeenschappelijke axonale steel komen. De meerderheid van de eiwitten gesynthetiseerd door de DRG of trigeminale ganglioncel worden gedistribueerd naar zowel centrale als perifere terminals. Dit onderscheidt het primaire afferente neuron van het prototypische neuron, waar de ontvangende tak van het neuron (de dendriet) biochemisch verschilt van de transmissietak (het axon). De biochemische gelijkwaardigheid van centrale en perifere terminals betekent dat de nociceptor berichten van elk uiteinde kan verzenden en ontvangen. Bijvoorbeeld, net zoals de centrale terminal de locus is van Ca2 + -afhankelijke afgifte van neurotransmitters, zodat de perifere terminal een verscheidenheid aan moleculen vrijgeeft die de lokale weefselomgeving beïnvloeden. Neurogene ontsteking verwijst in feite naar het proces waarbij perifere afgifte van de neuropeptiden, CGRP en stof P vaatverwijding en extravasatie van respectievelijk plasmaproteïnen induceert (Basbaum en Jessell, 2000). Verder, terwijl alleen de perifere terminal van de nociceptor zal reageren op omgevingsstimuli (pijnlijke warmte, koude en mechanische stimulatie), kunnen zowel de perifere als centrale terminals worden aangevallen door een groot aantal endogene moleculen (zoals pH, lipiden en neurotransmitters) die de gevoeligheid regelen. Hieruit volgt dat therapeutica gericht op beide terminals kunnen worden ontwikkeld om de transmissie van pijnberichten te beïnvloeden. Bijvoorbeeld, spinale (intrathecale) afgifte van op morfine gerichte opioïde receptoren tot expressie gebracht door de centrale terminal van nociceptoren, terwijl plaatselijk aangebrachte geneesmiddelen (zoals lokale anesthetica of capsaïcine) pijn reguleren via een actie aan de perifere terminal.
Centrale projecties van de nociceptor
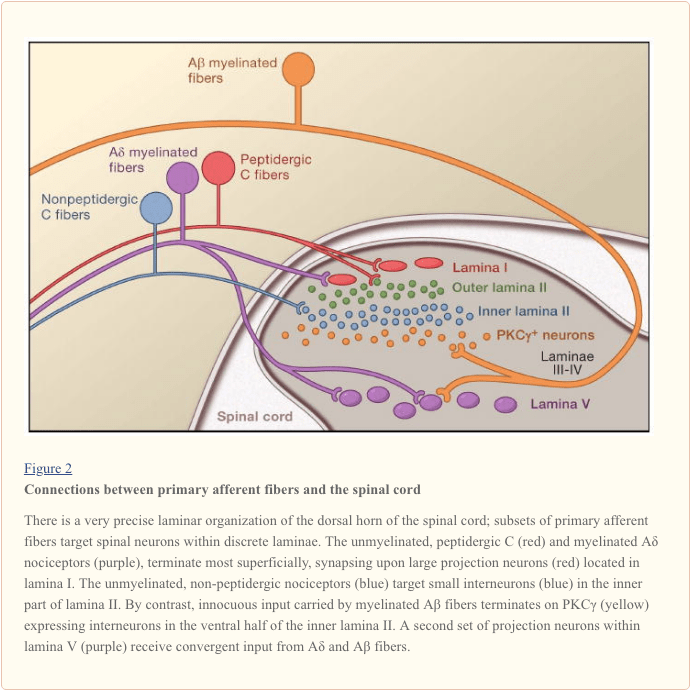
Primaire afferente zenuwvezels steken uit naar de dorsale hoorn van het ruggenmerg, die is georganiseerd in anatomisch en elektrofysiologisch onderscheiden laminae (Basbaum en Jessell, 2000) (Figuur 1). Bijvoorbeeld A? nociceptoren projecteren zowel naar lamina I als naar diepere dorsale hoorn (lamina V). De lage drempel, snel geleidende A? afferenten, die reageren op lichte aanraking, projecteren naar diepe laminaten (III, IV en V). Daarentegen projecteren C nociceptoren oppervlakkiger naar laminae I en II.
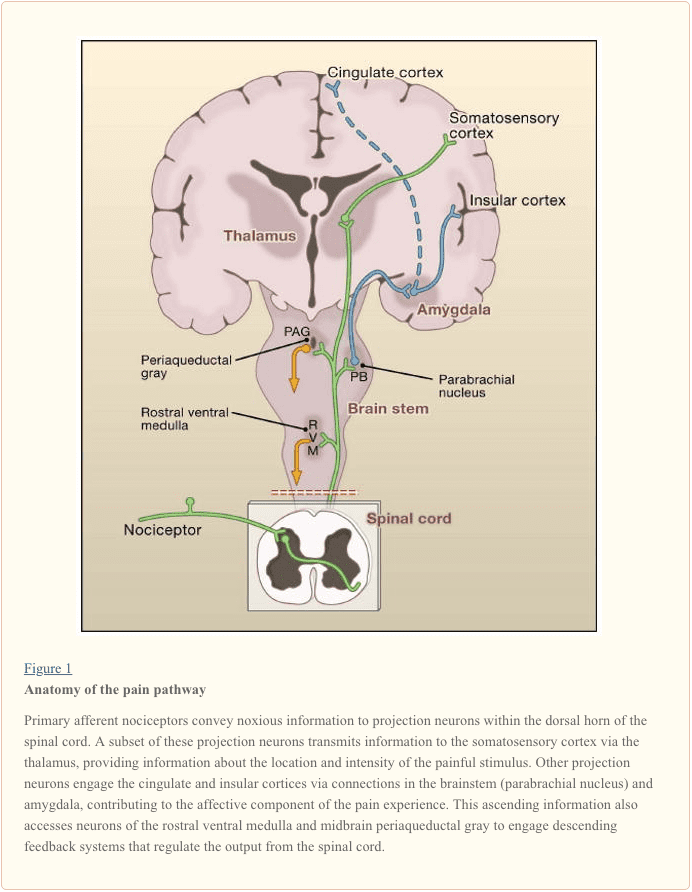
Deze opmerkelijke gelaagdheid van afferente subtypen binnen de oppervlakkige dorsale hoorn wordt verder benadrukt door de verschillende projectiepatronen van C nociceptoren (Snider en McMahon, 1998). De meeste peptidergische C-vezels eindigen bijvoorbeeld in lamina I en het meest dorsale deel van lamina II. Daarentegen eindigen de niet-peptidergische afferenten, waaronder de Mrg tot expressie brengende subset, in het middengebied van lamina II. Het meest ventrale deel van lamina II wordt gekenmerkt door de aanwezigheid van prikkelende interneuronen die de gamma-isovorm van proteïnekinase C (PKC) tot expressie brengen, die in verband is gebracht met door letsel veroorzaakte aanhoudende pijn (Malmberg et al., 1997). Recente onderzoeken geven aan dat deze PKC? laag wordt voornamelijk aangevallen door gemyeliniseerde niet-nociceptieve afferenten (Neumann et al., 2008). In overeenstemming met deze anatomische studies tonen elektrofysiologische analyses aan dat neuronen van het ruggenmerg in lamina I over het algemeen reageren op schadelijke stimulatie (via A? En C-vezels), neuronen in laminae III en IV reageren voornamelijk op onschadelijke stimulatie (via A?), En neuronen in lamina V ontvangen een convergente niet-schadelijke en schadelijke input via directe (monosynaptische) A? en een? inputs en indirecte (polysynaptische) C-vezelingangen. Deze laatste worden breed dynamisch bereik (WDR) neuronen genoemd, omdat ze reageren op een breed scala aan stimulusintensiteiten. Er is ook gewoonlijk een viscerale input naar deze WDR-neuronen, zodat de resulterende convergentie van somatische en viscerale waarschijnlijk bijdraagt aan het fenomeen van doorverwezen pijn, waarbij pijn secundair aan een verwonding die een visceraal weefsel (bijvoorbeeld het hart bij angina pectoris) aantast verwezen naar een somatische structuur (bijvoorbeeld de schouder).
Ascending Pathways en de Supraspinal Processing of Pain
Projectie-neuronen in laminae I en V vormen de belangrijkste output van de dorsale hoorn naar de hersenen (Basbaum en Jessell, 2000). Deze neuronen bevinden zich aan de oorsprong van meerdere oplopende paden, waaronder de spinothalamische en spinoreticulothalamische traktaten, die pijnberichten naar respectievelijk de thalamus en de hersenstam dragen (figuur 2). De eerste is vooral relevant voor de sensorisch discriminerende aspecten van de pijnervaring (dat wil zeggen, waar is de stimulus en hoe intens is hij?), Terwijl de laatste mogelijk relevanter is voor slecht gelokaliseerde pijnen. Meer recent richtte de aandacht zich op projecties van het ruggenmerg op het parabrachiale gebied van de dorsolaterale pons, omdat de output van dit gebied een zeer snelle verbinding met de amygdala verschaft, een regio die algemeen wordt beschouwd als informatie die relevant is voor de aversieve eigenschappen van de pijn. ervaring.
Van deze hersenstam en thalamische loci bereikt informatie corticale structuren. Er is geen enkel hersengebied dat essentieel is voor pijn (Apkarian et al., 2005). Integendeel, pijn is het gevolg van activering van een gedistribueerde groep van structuren, waarvan sommige meer geassocieerd zijn met de sensorisch-discriminerende eigenschappen (zoals de somatosensorische cortex) en anderen met de emotionele aspecten (zoals de anterior cingulate gyrus en de insulaire cortex). Meer recentelijk tonen beeldvormingsstudies activering van prefrontale corticale gebieden aan, evenals regio's die in het algemeen niet geassocieerd zijn met pijnverwerking (zoals de basale ganglia en de kleine hersenen). Of en in welke mate de activering van deze regio's meer gerelateerd is aan de reactie van het individu op de stimulus of aan de perceptie van de pijn, is niet duidelijk. Ten slotte illustreert figuur 2 de krachtige afdalende bedieningselementen die (zowel positief als negatief) de overdracht van pijnberichten op het niveau van het ruggenmerg beïnvloeden.
Acute pijn
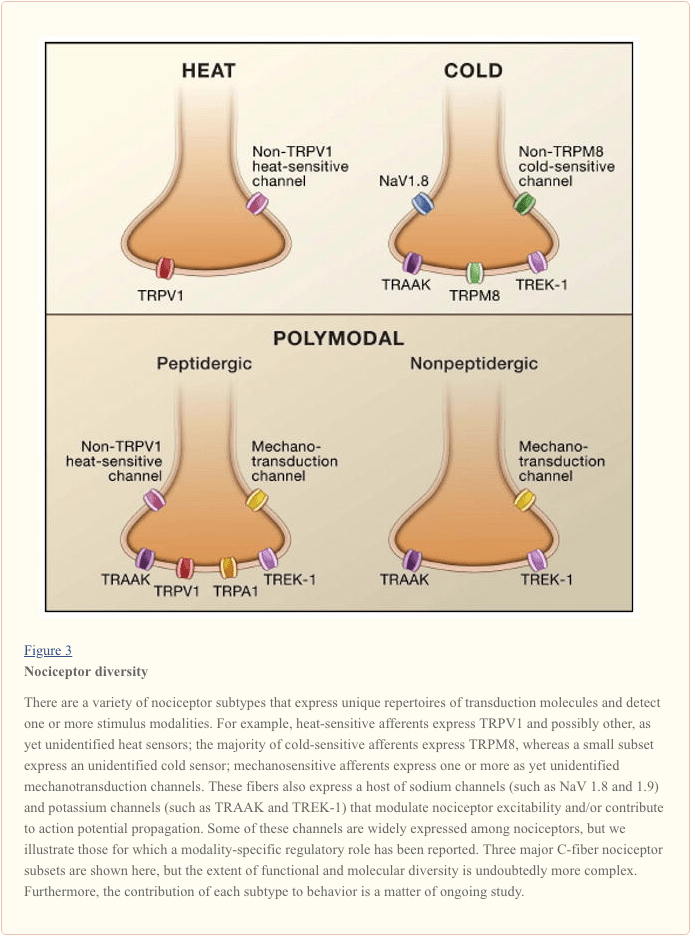
De primaire afferente zenuwvezel detecteert omgevingsstimuli (van een thermische, mechanische of chemische aard) en transduceert deze informatie in de taal van het zenuwstelsel, namelijk elektrische stroom. Eerst bespreken we de voortgang in het begrijpen van de moleculaire basis van signaaldetectie en volgen deze met een kort overzicht van recente genetische studies die de bijdrage van spanningsafhankelijke kanalen aan pijnoverdracht benadrukken (figuur 3).
De nociceptor activeren: verwarmen
Psychofysische studies bij mensen hebben aangetoond dat er een duidelijke en reproduceerbare scheidslijn is tussen de perceptie van onschadelijke warmte en schadelijke warmte, waardoor we temperaturen die weefselbeschadiging kunnen veroorzaken, kunnen herkennen en vermijden. Deze pijngrens, die doorgaans rond de 43°C ligt, loopt parallel met de warmtegevoeligheid van C en Type II A? eerder beschreven nociceptoren. Gekweekte neuronen van gedissocieerde dorsale wortelganglia vertonen inderdaad een vergelijkbare warmtegevoeligheid. De meerderheid vertoont een drempel van 43°C, met een kleiner cohort geactiveerd door intensere hitte (drempel >50°C) (Cesare en McNaughton, 1996; Kirschstein et al., 1997; Leffler et al., 2007; Nagy en Rang , 1999). Moleculaire inzichten in het proces van warmtesensatie kwamen voort uit het klonen en functionele karakterisering van de receptor voor capsaïcine, het belangrijkste prikkelende ingrediënt in 'hete' chilipepers. Capsaïcine en verwante vanilloïde verbindingen produceren brandende pijn door specifieke subsets van C en A te depolariseren. nociceptoren door activering van de capsaïcine (of vanilloïde) receptor, TRPV1, een van de ongeveer 30 leden van de grotere transiënte receptorpotentiaal (TRP) ionkanaalfamilie (Caterina et al., 1997). Het gekloonde TRPV1-kanaal wordt ook beveiligd door verhogingen van de omgevingstemperatuur, met een thermische activeringsdrempel (-43°C).
Verschillende bewijslijnen ondersteunen de hypothese dat TRPV1 een endogene transducer is van schadelijke warmte. Ten eerste wordt TRPV1 uitgedrukt in het merendeel van de warmtegevoelige nociceptoren (Caterina et al., 1997). Ten tweede zijn capsaïcine- en warmte-opgewekte stromen vergelijkbaar, zo niet identiek, met betrekking tot hun farmacologische en biofysische eigenschappen, evenals die van heteroloog tot expressie gebrachte TRPV1-kanalen. Ten derde, en zoals hieronder in meer detail wordt beschreven, worden door TRPV1 opgewekte responsen duidelijk versterkt door pro-algenische of pro-inflammatoire middelen (zoals extracellulaire protonen, neurotrofinen of bradykinine), die allemaal overgevoelig zijn voor warmte in vivo (Tominaga et al., 1998)). Ten vierde onthulde de analyse van muizen zonder dit ionenkanaal niet alleen een volledig verlies van de gevoeligheid voor capsaïcine, maar deze dieren vertonen ook een significante beperking in hun vermogen om schadelijke warmte te detecteren en erop te reageren (Caterina et al., 2000; Davis et al., 2000 ). Deze studies toonden ook een essentiële rol voor dit kanaal in het proces waarbij weefselbeschadiging en ontsteking leiden tot hypergevoeligheid voor warmte, wat het vermogen van TRPV1 om te dienen als een moleculaire integrator van thermische en chemische stimuli weergeeft (Caterina et al., 2000; Davis et al. ., 2000).
De bijdrage van TRPV1 aan acute warmtesensatie is echter geprovoceerd door gegevens die zijn verzameld van een ex vivo preparaat waarbij opnames worden verkregen van de soma van DRG-neuronen met intacte centrale en perifere vezels. In één onderzoek werden geen verschillen waargenomen in warmte-opgewekte reacties van wildtype en TRPV1-deficiënte dieren (Woodbury et al., 2004), maar een meer recente analyse van deze groep wees uit dat TRPV1-deficiënte muizen inderdaad een gebrek aan cohort van neuronen die robuust worden geactiveerd door schadelijke warmte (Lawson et al., 2008). Samen genomen met de hierboven beschreven resultaten concluderen wij dat TRPV1 onbetwistbaar bijdraagt tot acute warmte-sensatie, maar zijn het erover eens dat TRPV1 niet als enige verantwoordelijk is voor warmteoverdracht.
In dit opzicht, terwijl TRPV1-deficiënte muizen een component van gedragswarmtegevoeligheid missen, resulteert het gebruik van hoge doses capsaïcine voor ablatie van de centrale aansluitpunten van TRPV1 tot expressie brengende primaire afferente vezels in een meer diepgaand, zo niet volledig verlies van acute warmte pijngevoeligheid (Cavanaugh et al., 2009). Wat betreft de TRPV1-mutant, er is ook een verlies van door weefselschade opgewekte hyperalgesie van de hitte. Alles bij elkaar geven deze resultaten aan dat zowel de TRPV1-afhankelijke als de TRPV1-onafhankelijke component van schadelijke warmtegevoeligheid wordt gemedieerd via nociceptoren die TRPV1 tot expressie brengen.
Wat verklaart de TRPV1-onafhankelijke component van hittesensatie? Een aantal andere TRPV-kanaalsubtypen, waaronder TRPV2, 3 en 4, zijn naar voren gekomen als kandidaat-warmtetransducers die mogelijk de detectie kunnen dekken van stimulusintensiteiten die die van TRPV1 flankeren, waaronder zowel zeer heet (> 50 ° C) als warm (midden-30 ° C). ° Cs) temperaturen (Lumpkin en Caterina, 2007). Heteroloog tot expressie gebrachte TRPV2-kanalen vertonen een temperatuuractiveringsdrempel van? 52 ° C, terwijl TRPV3 en TRPV4 worden geactiveerd tussen 25 - 35 ° C. TRPV2 wordt uitgedrukt in een subpopulatie van A? neuronen die reageren op schadelijke hitte met een hoge drempel en de biofysische eigenschappen ervan lijken op die van natuurlijke, door warmte opgewekte stromen met hoge drempelwaarden (Leffler et al., 2007; Rau et al., 2007). Tot nu toe zijn er geen gepubliceerde rapporten die fysiologische of gedragstests van TRPV2-knock-outmuizen beschrijven. Aan de andere kant vertonen TRPV3- en TRPV4-deficiënte muizen een veranderde thermische voorkeur wanneer ze op een oppervlak met gegradeerde temperaturen worden geplaatst, wat suggereert dat deze kanalen op de een of andere manier bijdragen aan temperatuurdetectie in vivo (Guler et al., 2002). Interessant is dat zowel TRPV3 als TRPV4 een aanzienlijk grotere expressie vertonen in keratinocyten en epitheelcellen in vergelijking met sensorische neuronen, waardoor de mogelijkheid wordt vergroot dat detectie van onschadelijke warmtestimuli een functioneel samenspel tussen de huid en de onderliggende primaire afferente vezels inhoudt (Chung et al., 2003; Peier et al., 2002b).
De nociceptor activeren: koud
Wat capsaïcine en TRPV1 betreft, zijn natuurlijke koelmiddelen, zoals menthol en eucalyptol, gebruikt als farmacologische sondes om koudegevoelige vezels en cellen te identificeren en te karakteriseren (Hensel en Zotterman, 1951; Reid en Flonta, 2001) en de moleculen die eraan ten grondslag liggen hun gedrag. Inderdaad, de meeste koudegevoelige neuronen reageren op menthol en vertonen een thermische activeringsdrempel van -25°C. TRPM8 is een koude- en mentholgevoelig kanaal waarvan de fysiologische kenmerken overeenkomen met die van inheemse koudestromen en TRPM8-deficiënte muizen vertonen een zeer substantieel verlies van menthol en koude-opgewekte reacties op cellulair of zenuwvezelniveau. Evenzo vertonen deze dieren ernstige tekortkomingen in door koude opgewekte gedragsreacties (Bautista et al., 2007; Colburn et al., 2007; Dhaka et al., 2007) over een breed temperatuurbereik van 30 tot 10 ° C. Zoals in het geval van TRPV1 en hij bij, zijn TRPM8-deficiënte muizen niet volledig ongevoelig voor kou. Er blijft bijvoorbeeld een klein (?4%) cohort van koudegevoelige, menthol-ongevoelige neuronen over met een lage activeringsdrempel, van ongeveer 12°C. Deze kunnen de resterende koudegevoeligheid verklaren die wordt gezien in gedragstesten, waarbij TRPM8-deficiënte dieren nog steeds extreem koude oppervlakken onder 10 ° C kunnen vermijden. Belangrijk is dat muizen met TRPM8-deficiëntie een normale gevoeligheid voor schadelijke hitte vertonen. TRPV1 en TRPM8 komen inderdaad tot expressie in grotendeels niet-overlappende neuronale populaties, in overeenstemming met het idee dat warme en koude detectiemechanismen zijn georganiseerd in anatomisch en functioneel verschillende 'gelabelde lijnen'.
Op basis van heterologe expressiesystemen is TRPA1 ook gesuggereerd om koude te detecteren, met name binnen het schadelijke bereik (<15 ° C). Bovendien wordt TRPA1 geactiveerd door de afkoelende verbindingen icilin en menthol (Bandell et al., 2004; Karashima et al., 2007; Story et al., 2003), zij het in relatief hoge concentraties vergeleken met hun werking bij TRPM8. Er blijft echter onenigheid bestaan over de vraag of natieve of recombinante TRPA1 intrinsiek koudegevoelig is (Bandell et al., 2004; Jordt et al., 2004; Karashima et al., 2009; Nagata et al., 2005; Zurborg et al. ., 2007). Deze controverse is niet opgelost door de analyse van twee onafhankelijke TRPA1-deficiënte muislijnen. Op cellulair niveau toonde één studie normale koud opgewekte reacties in TRPA1-deficiënte neuronen na een temperatuurdaling van 30 seconden van 22 ° C naar 4 ° C (Bautista et al., 2006); een recentere studie heeft een afname van koudegevoelige neuronen aangetoond van 26% (WT) tot 10% (TRPA1 - / -), wanneer getest na een temperatuurdaling van 200 seconden, van 30 ° C tot 10 ° C (Karashima et al. ., 2009). In gedragsstudies vertonen TRPA1-deficiënte muizen reacties die vergelijkbaar zijn met wild-type nestgenoten in de koude plaat en door aceton opgewekte verdampingskoelingstesten (Bautista et al., 2006). Een tweede studie met dezelfde assays toonde aan dat vrouwelijke, maar niet mannelijke, TRPA1 knock-out dieren een verminderde gevoeligheid voor koude vertoonden in vergelijking met wildtype nestgenoten (Kwan et al., 2006). Karashima et al vonden geen verschil in de latentie van rillen of het terugtrekken van pootjes bij mannelijke of vrouwelijke TRPA1-deficiënte muizen op de koude plaattest, maar merkten op dat langdurige blootstelling aan het koude oppervlak springen opwekte bij wildtype, maar niet bij TRPA1-deficiënte dieren (Karashima et al. al., 2009). Het is denkbaar dat het laatste fenotype een bijdrage van TRPA1 aan koude gevoeligheid in de setting van weefselschade weerspiegelt, maar niet aan acute koude pijn. In overeenstemming met de laatste hypothese, laten opnames van enkelvoudige zenuwvezels geen afname zien in acute koude gevoeligheid bij TRPA1-deficiënte muizen (Cavanaugh et al., 2009; Kwan et al., 2009). Ten slotte is het opmerkelijk dat met capsaïcine behandelde muizen zonder de centrale uiteinden van TRPV1-expressieve vezels intacte gedragsreacties vertonen op koele en schadelijke koude stimuli (Cavanaugh et al., 2009). Omdat TRPA1 tot expressie wordt gebracht in een subset van TRPV1-positieve neuronen, volgt hieruit dat TRPA1 niet vereist is voor normale acute koude gevoeligheid. Toekomstige studies met muizen die deficiënt zijn voor zowel TRPM8 als TRPA1 zullen helpen deze problemen op te lossen en de moleculen en celtypen te identificeren die ten grondslag liggen aan de resterende TRPM8-onafhankelijke component van koude gevoeligheid.
Bijkomende moleculen, waaronder spanningsafhankelijke natriumkanalen (hieronder besproken), spanningsgerichte kaliumkanalen en tweekorige achtergrond-KCNK-kaliumkanalen, coördineren met TRPM8 voor het fijnregelen van koude drempels of voor het propageren van koude opgewekte actiepotentialen (Viana et al. , 2002; Zimmermann et al., 2007; Noel et al., 2009). Specifieke Kv1-remmers verhogen bijvoorbeeld de temperatuurdrempel van koude gevoelige neuronen en injectie van deze remmers in de knaagdierachterpoot vermindert gedragsreacties tegen koude, maar niet tegen hitte of mechanische stimuli (Madrid et al., 2009). Twee leden van de KCNK-kanaalfamilie, KCNK2 (TREK-1) en KCNK4 (TRAAK), worden uitgedrukt in een subset van C-fiber nociceptoren (Noel et al., 2009) en kunnen worden gemoduleerd door talrijke fysiologische en farmacologische stimuli, waaronder druk en temperatuur. Bovendien vertonen muizen zonder deze kanalen abnormaliteiten in gevoeligheid voor druk, warmte en koude (Noel et al., 2009). Hoewel deze bevindingen suggereren dat de TREK-1- en TRAAK-kanalen de prikkelbaarheid van nociceptoren moduleren, blijft het onduidelijk hoe hun intrinsieke gevoeligheid voor fysieke stimuli zich verhoudt tot hun in vivo bijdrage aan thermische of mechanische transductie.
De nociceptor activeren: mechanisch
Het somatosensorische systeem detecteert kwantitatief en kwalitatief diverse mechanische prikkels, variërend van licht borstelen van de huid tot uitzetting van de blaaswand. Een verscheidenheid aan mechanosensitieve neuronale subtypen zijn gespecialiseerd om deze diverse reeks mechanische stimuli te detecteren en kunnen worden gecategoriseerd op basis van drempelgevoeligheid. Mechanoreceptoren met hoge drempelwaarden omvatten C-vezels en passen zich langzaam aan A? mechanoreceptor (AM) vezels, die beide eindigen als vrije zenuwuiteinden in de huid. Laagdrempelige mechanoreceptoren omvatten A? D-haarvezels die eindigen op donsharen in de huid en lichte aanraking detecteren. Eindelijk, A? vezels die Merkel-cellen, Pacinian-bloedlichaampjes en haarzakjes innerveren, detecteren textuur, trillingen en lichte druk.
Net als in het geval van thermische stimuli, is mechanische gevoeligheid onderzocht op een aantal niveaus, waaronder gedissocieerde sensorische neuronen in kweek, ex-vivo vezelopnames, alsook opnames van centrale (dwz dorsale hoornneuronen) en metingen van gedragsoutput. Ex-vivo huid-zenuwopnames waren het meest informatief bij het matchen van stimuluseigenschappen (zoals intensiteit, frequentie, snelheid en aanpassing) aan specifieke vezelsubtypen. Bijvoorbeeld A? vezels worden voornamelijk geassocieerd met gevoeligheid voor lichte aanraking, terwijl C en A? vezels reageren voornamelijk op schadelijke mechanische beschadigingen. Op gedragsniveau wordt mechanische gevoeligheid doorgaans beoordeeld met behulp van twee technieken. De meest voorkomende betreft het meten van reflexreacties op constante kracht die wordt uitgeoefend op de achterpoot van het knaagdier door gekalibreerde filamenten (Von Frey-haren). De tweede oefent via een klemsysteem toenemende druk uit op de poot of staart. In beide gevallen wordt informatie over mechanische drempels verkregen onder normale (acuut) of letsel (overgevoeligheid) situaties. Een van de uitdagingen op dit gebied was het ontwikkelen van aanvullende gedragstesten die verschillende aspecten van mechanosensatie meten, zoals textuurdiscriminatie en vibratie, wat de studie van zowel schadelijke als niet-schadelijke aanraking zal vergemakkelijken (Wetzel et al., 2007).
Op cellulair niveau kan druk worden uitgeoefend op de cellichamen van gekweekte somatosensorische neuronen (of op hun neurieten) met behulp van een glassensor, veranderingen in osmotische sterkte, of rek via uitzetting van een elastisch kweekoppervlak, hoewel het onduidelijk is welke stimulus het beste is bootst fysiologische druk na (Bhattacharya et al., 2008; Cho et al., 2006; Cho et al., 2002; Drew et al., 2002; Hu en Lewin, 2006; Lin et al., 2009; Takahashi en Gotoh, 2000 ). Antwoorden kunnen worden beoordeeld met behulp van elektrofysiologische of live cell imaging-methoden. De consensus van dergelijke studies is dat die druk een mechanisch gevoelig kationkanaal opent om snelle depolarisatie te veroorzaken. Een tekort aan specifieke farmacologische probes en moleculaire markers waarmee deze responsen kunnen worden gekarakteriseerd of om relevante neuronale subtypes te labelen, heeft pogingen om cellulaire activiteiten met anatomisch of functioneel gedefinieerde zenuwvezelsubklassen te evenaren belemmerd. Deze beperkingen hebben ook de moleculaire analyse van mechansosensatie en de identificatie van moleculen die de mechanotransductiemachinerie vormen, belemmerd. Niettemin zijn er een aantal kandidaten naar voren gekomen, grotendeels gebaseerd op studies van mechanosensatie in model genetische organismen. Zoogdierorthologen van deze eiwitten zijn onderzocht met behulp van benaderingen van genen in muizen, waarbij de hierboven genoemde technieken kunnen worden gebruikt om gebreken in mechanosensatie op alle niveaus te beoordelen. Hieronder geven we een korte samenvatting van enkele van de kandidaten die in deze onderzoeken zijn onthuld.
Kandidaat-mechanotransducers: DEG / ENaC-kanalen
Studies in de nematode Caenorhabditis elegans (C. elegans) hebben mec-4 en mec-10 geïdentificeerd, leden van de degenerine / epitheliale Na + kanaal (DEG / ENaC) families, als mechanotransducers in body touch neuronen (Chalfie, 2009). Op basis van deze studies zijn de zoogdierorthologen ASIC 1, 2 en 3 voorgesteld als mechanotransductiekanalen. ASICs zijn zuurgevoelige ionkanalen die dienen als receptoren voor extracellulaire protonen (weefselacidose) geproduceerd tijdens ischemie (zie hieronder). Hoewel deze kanalen tot expressie worden gebracht door zowel lage als hoge drempel mechanosensitieve neuronen, ondersteunen genetische studies niet uniform een essentiële rol in mechanotransductie. Muizen zonder functionele ASIC1-kanalen vertonen normale gedragsreacties op cutane aanraking en weinig of geen verandering in mechanische gevoeligheid wanneer beoordeeld door opname met enkele vezel (Page et al., 2004; Price et al., 2000). Evenzo vertonen perifere zenuwvezels van ASIC2-deficiënte muizen slechts een kleine afname van actiepotentiëring naar mechanische stimuli, terwijl ASIC3-deficiënte vezels een lichte toename vertonen (geen verandering in mechanische drempels of basale gedragsmatige mechanische gevoeligheid werd waargenomen bij deze dieren) ( Price et al., 2001; Roza et al., 2004). Analyse van muizen die deficiënt zijn voor zowel ASIC2 als ASIC3 ondersteunt evenmin een rol voor deze kanalen bij cutane mechanotransductie (Drew et al., 2004). Hoewel deze kanalen een rol blijken te spelen bij musculoskeletale en ischemische pijn (zie hieronder), blijft hun bijdrage aan mechanosensatie onopgelost.
Genetische studies suggereren dat C. elegans mec-4 / mec-10-kanalen bestaan in een complex met het stomatine-achtige eiwit MEC-2 (Chalfie, 2009). Muizen die de MEC-2-ortholoog, SLP3, missen, vertonen een verlies van mechanosensitiviteit in laagdrempelige A? en een? vezels, maar niet in C-vezels (Wetzel et al., 2007). Deze muizen vertonen een veranderde tactiele scherpte, maar vertonen normale reacties op schadelijke druk, wat suggereert dat SLP3 bijdraagt aan de detectie van onschadelijke, maar niet schadelijke mechanische stimuli. Of SLP3 functioneert in een mechanotransductiecomplex of interageert met ASIC's in sensorische neuronen van zoogdieren is onbekend.
Kandidaat-mechanotransducers: TRP-kanalen
Zoals hierboven opgemerkt, reageert TRPV2, wanneer het heteroloog tot expressie wordt gebracht, niet alleen op schadelijke warmte, maar ook op osmotische rek. Bovendien worden natieve TRPV2-kanalen in vasculaire gladde spiercellen geactiveerd door directe afzuiging en osmotische stimuli (Muraki et al., 2003). Een rol voor TRPV2 voor somatosensorische mechanotransductie in vivo is nog niet getest.
TRPV2 wordt robuust uitgedrukt in middelgrote en grote diameter, A? vezels die reageren op zowel mechanische als thermische stimuli (Caterina et al., 1999; Muraki et al., 2003). TRPV4 vertoont een bescheiden expressie in sensorische ganglia, maar wordt overvloediger tot expressie gebracht in de nier en rekgevoelige urotheelcellen van de blaas (Gevaert et al., 2007; Mochizuki et al., 2009). Wanneer het heteroloog wordt uitgedrukt, is aangetoond dat zowel TRPV2 als TRPV4 reageren op veranderingen in osmotische druk (Guler et al., 2002; Liedtke et al., 2000; Mochizuki et al., 2009; Strotmann et al., 2000). Analyse van TRPV4-deficiënte dieren suggereert een rol bij osmosensatie, aangezien knock-out dieren defecten vertonen in bloeddruk, waterbalans en blaaslediging (Gevaert et al., 2007; Liedtke en Friedman, 2003). Deze dieren vertonen normale acute huidmechanosensatie, maar vertonen tekorten in modellen van mechanische en thermische hyperalgesie (Alessandri-Haber et al., 2006; Chen et al., 2007; Grant et al., 2007; Suzuki et al., 2003). Het is dus onwaarschijnlijk dat TRPV4 zal dienen als een primaire mechanotransducer in sensorische neuronen, maar kan bijdragen aan door letsel opgewekte pijnovergevoeligheid.
TRPA1 is ook voorgesteld om te dienen als een detector van mechanische stimuli. Heteroloog tot expressie gebrachte zoogdier-TRPA1 wordt geactiveerd door membraancrenatoren (Hill en Schaefer, 2007) en de wormortholoog is gevoelig voor mechanische druk die wordt uitgeoefend via een zuigpipet (Kindt et al., 2007). TRPA1-deficiënte muizen vertonen echter slechts zwakke defecten in mechanosensorisch gedrag en de resultaten zijn inconsistent. Twee studies rapporteerden geen verandering in mechanische drempels bij TRPA1-deficiënte dieren (Bautista et al., 2006; Petrus et al., 2007), terwijl een derde studie tekorten rapporteerde (Kwan et al., 2006). Een recentere studie toont aan dat C en A? mechanosensitieve vezels in TRPA1 knock-out dieren hebben veranderde reacties op mechanische stimulatie (sommige zijn toegenomen en andere afgenomen) (Kwan et al., 2009). Of en hoe deze differentiële fysiologische effecten zich manifesteren op het niveau van gedrag is onduidelijk. Bij elkaar genomen lijkt TRPA1 niet te functioneren als een primaire detector van acute mechanische stimuli, maar misschien moduleert het de exciteerbaarheid van mechanosensitieve afferenten.
Kandidaat-mechanotransducers: KCNK-kanalen
Naast de potentiële mechanotransducer-rol van KCNK2 en 4 (zie hierboven), is KCNK18 besproken vanwege zijn mogelijke bijdrage aan mechanosensatie. KCNK18 is dus het doelwit van hydroxy-a-sanshool, het prikkelende ingrediënt in Szechuan-peperkorrels dat tintelende en verdovende sensaties produceert, wat duidt op een interactie met aanraakgevoelige neuronen (Bautista et al., 2008; Bryant en Mezine, 1999; Sugai et al. al., 2005). KCNK18 wordt uitgedrukt in een subset van vermoedelijke peptidergische C-vezels en laagdrempelige (A?) Mechanoreceptoren, waar het dient als een belangrijke regulator van de duur en prikkelbaarheid van de actiepotentiaal (Bautista et al., 2008; Dobler et al., 2007). Bovendien depolariseert sanshool osmo- en mechanosensitieve sensorische neuronen met een grote diameter, evenals een subset van nociceptoren (Bautista et al., 2008; Bhattacharya et al., 2008). Hoewel het niet bekend is of KCNK18 direct gevoelig is voor mechanische stimulatie, kan het een kritische regulator zijn van de prikkelbaarheid van neuronen die betrokken zijn bij onschadelijke of schadelijke aanrakingssensaties.
Samengevat is de moleculaire basis van de mechanotransductie van zoogdieren nog lang niet opgehelderd. Mechanische overgevoeligheid als reactie op weefsel- of zenuwletsel vertegenwoordigt een groot klinisch probleem en aldus het ophelderen van de biologische basis van aanraking onder normale en pathofysiologische omstandigheden blijft een van de grootste uitdagingen in somatosensorisch en pijnonderzoek.
De nociceptor activeren: chemisch
Chemo-nociceptie is het proces waarbij primaire afferente neuronen omgevingsirriterende stoffen en endogene factoren die worden geproduceerd door fysiologische stress, detecteren. In de context van acute pijn, veroorzaken chemo-nociceptieve mechanismen aversieve reacties op een verscheidenheid van omgevings irriterende stoffen. Ook hier hebben TRP-kanalen een prominente rol, wat misschien niet verrassend is, aangezien ze fungeren als receptoren voor irriterende stoffen afkomstig van planten, waaronder capsaïcine (TRPV1), menthol (TRPM8), evenals de doordringende ingrediënten in mosterd- en knoflookplanten, isothiocyanaten en thiosulfinaten (TRPA1) (Bandell et al., 2004; Caterina et al., 1997; Jordt et al., 2004; McKemy et al., 2002; Peier et al., 2002a).
Met betrekking tot irriterende stoffen in de omgeving is TRPA1 naar voren gekomen als een bijzonder interessant lid van deze groep. Dit komt omdat TRPA1 reageert op verbindingen die structureel divers zijn maar verenigd in hun vermogen om covalente adducten te vormen met thiolgroepen. Allylisothiocyanaat (van wasabi) of allicine (van knoflook) zijn bijvoorbeeld membraanpermeabele elektrofielen die TRPA1 activeren door cysteïneresiduen covalent te modificeren binnen het amino-terminale cytoplasmatische domein van het kanaal (Hinman et al., 2006; Macpherson et al., 2007). Hoe dit channel gating bevordert, is momenteel niet bekend. Niettemin heeft het simpelweg vaststellen van het belang van thiolreactiviteit in dit proces TRPA1 geïmpliceerd als een belangrijk fysiologisch doelwit voor een brede en chemisch diverse groep van giftige stoffen in het milieu. Een opmerkelijk voorbeeld is acroleïne (2-propenal), een zeer reactief?,? - onverzadigd aldehyde dat aanwezig is in traangas, uitlaatgassen van voertuigen of rook van brandende vegetatie (dwz bosbranden en sigaretten). Acroleïne en andere vluchtige irriterende stoffen (zoals hypochloriet, waterstofperoxide, formaline en isocyanaten) activeren sensorische neuronen die de ogen en luchtwegen innerveren en pijn en ontsteking veroorzaken (Bautista et al., 2006; Bessac en Jordt, 2008; Caceres et al. , 2009). Deze actie kan vooral ernstige gevolgen hebben voor mensen die lijden aan astma, chronische hoest of andere longaandoeningen. Muizen zonder TRPA1 vertonen een sterk verminderde gevoeligheid voor dergelijke agentia, wat de kritische aard van dit kanaal als sensorische detector van reactieve irriterende stoffen uit de omgeving onderstreept (Caceres et al., 2009). Naast deze milieutoxines is TRPA1 het doelwit van enkele algemene anesthetica (zoals isofluoraan) of metabole bijproducten van chemotherapeutische middelen (zoals cyclofosfamide), die waarschijnlijk ten grondslag liggen aan enkele van de nadelige bijwerkingen van deze medicijnen, waaronder acute pijn en robuuste neuro-inflammatie. (Bautista et al., 2006; Matta et al., 2008).
Tenslotte worden chemische irriterende middelen en andere pro-algenische middelen ook endogeen geproduceerd in respons op weefselbeschadiging of fysiologische stress, waaronder oxidatieve stress. Dergelijke factoren kunnen alleen of in combinatie werken om nociceptoren te sensibiliseren voor thermische en / of mechanische stimuli, waardoor pijndrempels worden verlaagd. Het resultaat van deze actie is het verbeteren van de bewakings- en beschermende reflexen in de nasleep van een verwonding. Aldus vertegenwoordigt chemo-nociceptie een belangrijk grensvlak tussen acute en aanhoudende pijn, in het bijzonder in de context van perifere weefselbeschadiging en ontsteking, zoals hieronder in meer detail besproken.
Acute pijn: het pijnsignaal uitvoeren
Wanneer thermische en mechanische signalen eenmaal zijn getransduceerd door het primaire afferente uiteinde, activeert het receptorpotentiaal een verscheidenheid aan spanningsafhankelijke ionkanalen. Spanningsafhankelijke natrium- en kaliumkanalen zijn van cruciaal belang voor het genereren van actiepotentialen die nociceptorsignalen naar synapsen in de dorsale hoorn overbrengen. Spanningsafhankelijke calciumkanalen spelen een sleutelrol bij de afgifte van neurotransmitters uit centrale of perifere nociceptorterminals om respectievelijk pijn of neurogene ontsteking te genereren. We beperken onze discussie tot leden van de natrium- en calciumkanaalfamilies die dienen als doelwit van momenteel gebruikte pijnstillende geneesmiddelen, of waarvoor de menselijke genetica een rol bij pijnoverdracht ondersteunt. Een recent overzicht heeft de belangrijke bijdrage van KCNQ-kaliumkanalen besproken, waaronder het therapeutische voordeel van toenemende K + -kanaalactiviteit voor de behandeling van aanhoudende pijn (Brown en Passmore, 2009).
Voltage-gated natriumkanalen
Een verscheidenheid aan natriumkanalen wordt uitgedrukt in somatosensorische neuronen, waaronder de tetrodotoxine (TTX) gevoelige kanalen Nav1.1, 1.6 en 1.7, en de TTX-ongevoelige kanalen, Nav1.8 en 1.9. In de afgelopen jaren heeft de bijdrage van Nav1.7 veel aandacht gekregen, aangezien veranderde activiteit van dit kanaal leidt tot een verscheidenheid aan menselijke pijnstoornissen (Cox et al., 2006; Dib-Hajj et al., 2008). Patiënten met verlies van functie mutaties in dit gen zijn niet in staat om schadelijke prikkels te detecteren en lijden als gevolg daarvan aan letsels als gevolg van een gebrek aan beschermende reflexen. Daarentegen leidt een aantal gain-of-function-mutaties in Nav1.7 tot hyperexcitabiliteit van het kanaal en zijn ze geassocieerd met twee verschillende pijnstoornissen bij de mens, erythromelalgie en paroxismale extreme pijnstoornis, die beide intense brandende gevoelens veroorzaken (Estacion et al. ., 2008; Fertleman et al., 2006; Yang et al., 2004). Dierstudies hebben aangetoond dat Nav1.7 sterk opgereguleerd is in verschillende ontstekingspijnmodellen. Inderdaad, analyse van muizen zonder Nav1.7 in C nociceptoren ondersteunt een sleutelrol voor dit kanaal bij mechanische en thermische overgevoeligheid na ontsteking en bij acute reacties op schadelijke mechanische stimuli (Nassar et al., 2004). Enigszins verrassend is dat pijn geïnduceerd door zenuwletsel ongewijzigd is, wat suggereert dat verschillende natriumkanaalsubtypen, of een andere populatie van Nav1.7 tot expressie brengende afferenten, bijdragen aan neuropathische pijn (Nassar et al., 2005).
Het Nav1.8-natriumkanaal wordt ook sterk tot uitdrukking gebracht door de meeste C nociceptoren. Net als bij Nav1.7-knock-outdieren vertonen degenen zonder Nav1.8 bescheiden tekorten wat betreft gevoeligheid voor onschadelijke of schadelijke warmte of onschadelijke druk; ze vertonen echter verzwakte reacties op schadelijke mechanische stimuli (Akopian et al., 1999). Nav1.8 is ook nodig voor de overdracht van koude stimuli, omdat muizen die dit kanaal missen, ongevoelig zijn voor koude over een breed temperatuurbereik (Zimmermann et al., 2007). Dit komt omdat Nav1.8 uniek is onder voltage-gevoelige natriumkanalen omdat het niet bij lage temperatuur inactiveert, waardoor het de belangrijkste actiepotentiaalgenerator onder koude omstandigheden is.
Interessant is dat transgene muizen zonder de Nav1.8 tot expressie brengende subset van sensorische neuronen, die werden verwijderd door gerichte expressie van difterietoxine A (Abrahamsen et al., 2008), verzwakte responsen vertonen op zowel lage als hoge drempel mechanische stimuli en koude. Bovendien is mechanische en thermische overgevoeligheid in modellen van ontstekingspijn ernstig verzwakt. De differentiële fenotypen van muizen zonder Nav1.8-kanalen versus deletie van de Nav1.8 tot expressie brengende neuronen weerspiegelen vermoedelijk de bijdrage van meervoudige voltage-gepoorte natriumkanaalsubtypen aan transmissie van pijnberichten.
Spanningsafhankelijke natriumkanalen zijn het doelwit van lokale anesthetica, wat het potentieel voor de ontwikkeling van subtypespecifieke analgetica benadrukt. Nav1.7 is een bijzonder interessant doelwit voor de behandeling van inflammatoire pijnsyndromen, deels omdat de menselijke genetische studies suggereren dat Nav1.7-remmers de pijn zouden moeten verminderen zonder andere essentiële fysiologische processen te veranderen (zie hierboven). Een andere potentiële toepassing van natriumkanaalblokkers kan zijn om extreme overgevoeligheid voor koude te behandelen, een bijzonder lastig nadelig neveneffect van op platina gebaseerde chemotherapeutica, zoals oxaliplatin (Attal et al., 2009). Nav1.8 (of TRPM8) antagonisten kunnen dit verlichten, of andere vormen van koude allodynie. Ten slotte kan de grote bruikbaarheid van de antidepressiva voor de serotonine- en norepinefrineheropnameremmers voor de behandeling van neuropathische pijn in feite het gevolg zijn van hun vermogen om spanningsafhankelijke natriumkanalen te blokkeren (Dick et al., 2007).
Voltage-gated calciumkanalen
Een verscheidenheid aan spanningsafhankelijke calciumkanalen wordt uitgedrukt in nociceptoren. N-, P / Q- en T-type calciumkanalen hebben de meeste aandacht gekregen. P / Q-type kanalen worden uitgedrukt op synaptische uiteinden in laminae II-IV van de dorsale hoorn. Hun exacte rol bij nociceptie is niet volledig opgelost. Mutaties in deze kanalen zijn echter in verband gebracht met familiaire hemiplegische migraine (de Vries et al., 2009). N- en T-type calciumkanalen worden ook tot expressie gebracht door C-vezels en worden opgereguleerd onder pathofysiologische toestanden, zoals in modellen van diabetische neuropathie of na andere vormen van zenuwbeschadiging. Dieren zonder Cav2.2 of 3.2 vertonen verminderde sensibilisatie voor mechanische of thermische stimuli na respectievelijk ontsteking of zenuwbeschadiging (Cao, 2006; Swayne en Bourinet, 2008; Zamponi et al., 2009; Messinger et al., 2009). Bovendien wordt β-conotoxine GVIA, dat N-type kanalen blokkeert, intrathecaal toegediend (als ziconotide) om verlichting te bieden voor hardnekkige kankerpijn (Rauck et al., 2009).
Alle calciumkanalen zijn heteromere eiwitten die zijn samengesteld uit? 1 porievormende subeenheden en de modulerende subeenheden? 2?,? 2? of? 2 ?. De 2? subeenheid regelt de stroomdichtheid en de kinetiek van activering en inactivering. In C nociceptoren, de? 2? subeenheid wordt dramatisch opgereguleerd na zenuwbeschadiging en speelt een sleutelrol bij door letsel opgewekte overgevoeligheid en allodynie (Luo et al., 2001). Deze subeenheid is inderdaad het doelwit van de klasse van gabapentinoïde anticonvulsiva, die nu veel worden gebruikt om neuropathische pijn te behandelen (Davies et al., 2007).
Aanhoudende pijn: perifere mechanismen
Aanhoudende pijn geassocieerd met letsel of ziekten (zoals diabetes, artritis of tumorgroei) kan het gevolg zijn van veranderingen in de eigenschappen van perifere zenuwen. Dit kan gebeuren als gevolg van schade aan zenuwvezels, wat leidt tot een verhoogde spontane ontbranding of veranderingen in de geleiding of neurotransmittereigenschappen. In feite weerspiegelt het nut van lokale en zelfs systemische lokale anesthetica voor de behandeling van verschillende neuropathische pijnaandoeningen (zoals postherpetische neuralgie) waarschijnlijk hun werking op natriumkanalen die zich ophopen in beschadigde zenuwvezels.
Het chemische milieu van ontsteking
Perifere sensibilisatie is vaker het gevolg van met ontstekingen geassocieerde veranderingen in de chemische omgeving van de zenuwvezel (McMahon et al., 2008). Weefselbeschadiging gaat dus vaak gepaard met de accumulatie van endogene factoren die vrijkomen uit geactiveerde nociceptoren of niet-neurale cellen die zich bevinden in of infiltreren in het beschadigde gebied (inclusief mestcellen, basofielen, bloedplaatjes, macrofagen, neutrofielen, endotheelcellen, keratinocyten en fibroblasten). Collectief. deze factoren, de 'inflammatoire soep' genoemd, vertegenwoordigen een breed scala aan signaalmoleculen, waaronder neurotransmitters, peptiden (substantie P, CGRP, bradykinine), eicosinoïden en verwante lipiden (prostaglandinen, tromboxanen, leukotriënen, endocannabinoïden), neurotrofinen, cytokinen , en chemokinen, evenals extracellulaire proteasen en protonen. Opmerkelijk is dat nociceptoren een of meer celoppervlakreceptoren tot expressie brengen die in staat zijn om elk van deze pro-inflammatoire of pro-algetische middelen te herkennen en erop te reageren (Figuur 4). Dergelijke interacties verbeteren de prikkelbaarheid van de zenuwvezel, waardoor de gevoeligheid voor temperatuur of aanraking wordt verhoogd.
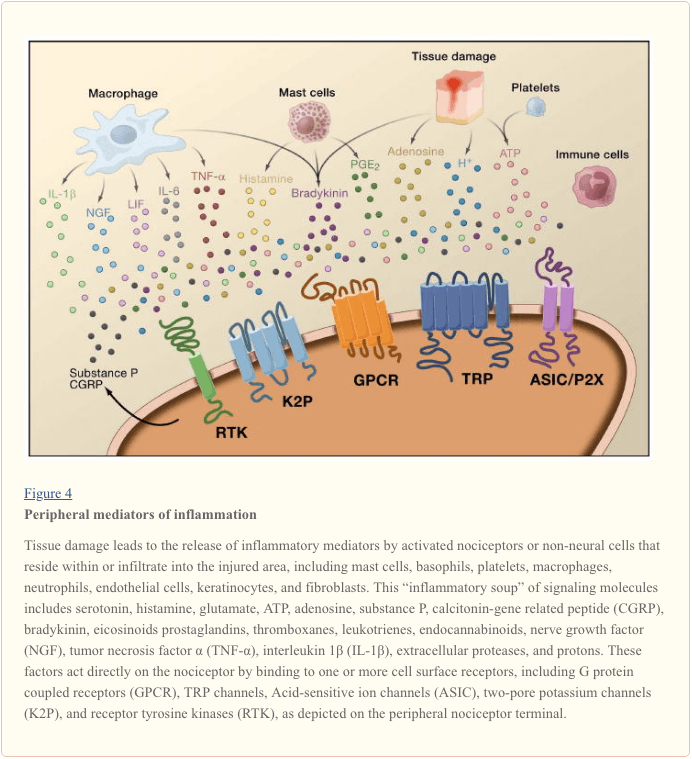
De meest voorkomende benadering om inflammatoire pijn te verminderen, is ongetwijfeld het remmen van de synthese of accumulatie van componenten van de ontstekingssoep. Dit wordt het best geïllustreerd door niet-steroïde anti-inflammatoire geneesmiddelen, zoals aspirine of ibuprofen, die ontstekingspijn en hyperalgesie verminderen door cyclo-oxygenasen (Cox-1 en Cox-2) die betrokken zijn bij prostaglandinesynthese te remmen. Een tweede benadering is om de acties van ontstekingsreacties bij de nociceptor te blokkeren. Hier lichten we voorbeelden toe die nieuw inzicht verschaffen in cellulaire mechanismen van perifere sensitisatie, of die de basis vormen voor nieuwe therapeutische strategieën voor de behandeling van ontstekingspijn.
NGF is misschien het best bekend om zijn rol als neurotrofe factor die nodig is voor de overleving en ontwikkeling van sensorische neuronen tijdens de embryogenese, maar in de volwassene wordt NGF ook geproduceerd in de setting van weefselbeschadiging en vormt een belangrijk onderdeel van de ontstekingssoep (Ritner et al., 2009). Van de vele cellulaire doelwitten werkt NGF rechtstreeks op peptidergische C-vezel-nociceptoren, die de hoge affiniteit van NGF-receptortyrosinekinase, TrkA tot expressie brengen, evenals de neurotrofe receptor met lage affiniteit, p75 (Chao, 2003; Snider en McMahon, 1998). NGF produceert een diepe overgevoeligheid voor warmte en mechanische stimuli door twee tijdelijk verschillende mechanismen. In eerste instantie activeert een NGF-TrkA-interactie stroomafwaartse signaalroutes, waaronder fosfolipase C (PLC), door mitogeen geactiveerd proteïnekinase (MAPK) en fosfoinositide 3-kinase (PI3K). Dit resulteert in functionele versterking van doeleiwitten aan de perifere nociceptor-terminal, met name TRPV1, hetgeen leidt tot een snelle verandering in cellulaire en gedragswarmtegevoeligheid (Chuang et al., 2001). Naast deze snelle acties wordt NGF ook retrograd getransporteerd naar de kern van de nociceptor, waar het verhoogde expressie van pro-nociceptieve eiwitten bevordert, waaronder substantie P, TRPV1 en de Nav1.8 spanningsafhankelijke natriumkanaalsubeenheid (Chao, 2003; Ji et al., 2002). Samen verbeteren deze veranderingen in genexpressie de prikkelbaarheid van de nociceptor en amplificeren ze de neurogene ontstekingsreactie.
Naast neurotrofines bevordert verwonding de afgifte van talrijke cytokines, waarvan de belangrijkste interleukine 1? (IL-1?) En IL-6, en tumornecrosefactor? (TNF-?) (Ritner et al., 2009). Hoewel er aanwijzingen zijn voor een directe werking van deze cytokinen op nociceptoren, is hun primaire bijdrage aan pijnovergevoeligheid het gevolg van versterking van de ontstekingsreactie en verhoogde productie van pro-algetische middelen (zoals prostaglandinen, NGF, bradykinine en extracellulaire protonen).
Ongeacht hun pro-nociceptieve mechanismen, is interferentie met neurotrofine- of cytokinesignalering een belangrijke strategie geworden voor het beheersen van ontstekingsziekte of resulterende pijn. De belangrijkste benadering omvat het blokkeren van NGF of TNF-? actie met een neutraliserend antilichaam. In het geval van TNF-? Was dit opmerkelijk effectief bij de behandeling van talrijke auto-immuunziekten, waaronder reumatoïde artritis, wat leidde tot een drastische vermindering van zowel weefselvernietiging als daarmee gepaard gaande hyperalgesie (Atzeni et al., 2005). Omdat de belangrijkste effecten van NGF op de volwassen nociceptor plaatsvinden in de setting van een ontsteking, is het voordeel van deze benadering dat hyperalgesie zal afnemen zonder de normale pijnperceptie te beïnvloeden. Inderdaad, anti-NGF-antilichamen zijn momenteel in klinische onderzoeken voor de behandeling van inflammatoire pijnsyndromen (Hefti et al., 2006).
Doelen van de inflammatoire soep
TRPV1. Bij een ontsteking of na injectie van specifieke componenten van de ontstekingssoep (zoals bradykinine of NGF) kan een robuuste overgevoeligheid voor warmte ontstaan. Het ontbreken van een dergelijke sensibilisatie bij TRPV1-deficiënte muizen biedt genetische ondersteuning voor het idee dat TRPV1 een sleutelcomponent is van het mechanisme waardoor ontsteking thermische hyperalgesie veroorzaakt (Caterina et al., 2000; Davis et al., 2000). In vitro-onderzoeken hebben inderdaad aangetoond dat TRPV1 functioneert als een polymodale signaalintegrator waarvan de thermische gevoeligheid diepgaand kan worden gemoduleerd door componenten van de ontstekingssoep (Tominaga et al., 1998). Sommige van deze ontstekingsmiddelen (bijvoorbeeld extracellulaire protonen en lipiden) functioneren als directe positieve allosterische modulatoren van het kanaal, terwijl andere (bradykinine, ATP en NGF) zich binden aan hun eigen receptoren op primaire afferenten en TRPV1 moduleren door activering van stroomafwaartse intracellulaire signaleringsroutes. In beide gevallen resulteren deze interacties in een sterke verlaging van de thermische activeringsdrempel van het kanaal, evenals een toename van de omvang van de reacties bij temperaturen boven de drempel - de biofysische equivalenten van respectievelijk allodynie en hyperalgesie.
Er blijft echter een controverse bestaan over de intracellulaire signaleringsmechanismen die het meest verantwoordelijk zijn voor TRPV1-modulatie (Lumpkin en Caterina, 2007). Herhalend aan de voorouderlijke TRP-kanalen in het vliegenoog, worden veel zoogdier-TRP-kanalen geactiveerd of positief gemoduleerd door fosfolipase C-gemedieerde splitsing van plasmamembraan fosfatidylinositol 4,5-bisfosfaat (PIP2). Natuurlijk zijn er vele gevolgen van deze actie, waaronder een afname van het membraan PIP2, verhoging van het gehalte aan diacylglycerol en zijn metabolieten, verhoogd cytoplasmatisch calcium, evenals de daaruit voortvloeiende activatie van proteïnekinasen. In het geval van TRPV1 zijn de meeste, zo niet alle, van deze routes betrokken bij het sensibiliseringsproces en valt nog te bezien welke het meest relevant zijn voor gedragsmatige thermische overgevoeligheid. Desalniettemin is er brede overeenstemming dat TRPV1-modulatie relevant is voor door weefselschade opgewekte overgevoeligheid voor pijn, in het bijzonder bij het instellen van ontsteking. Dit zou aandoeningen zoals zonnebrand, infectie, reumatoïde of osteoartritis en ontstekingskomziekte omvatten. Een ander interessant voorbeeld omvat pijn van botkanker (Honore et al., 2009), waarbij tumorgroei en botvernietiging gepaard gaan met extreem robuuste weefselacidose, evenals de productie van cytokinen, neurotrofinen en prostaglandinen.
TRPA1. Zoals hierboven beschreven, wordt TRPA1 geactiveerd door verbindingen die covalente adducten vormen met cysteïneresiduen. Naast milieutoxines omvat dit endogene thiol-reactieve elektrofielen die worden geproduceerd tijdens weefselschade en -ontsteking, of als gevolg van oxidatieve of nitratieve stress. De belangrijkste van dergelijke middelen zijn 4-hydroxy-2-nonenal en 15-deoxy-? 12,14-prostaglandine J2, die beide a,? Zijn. onverzadigde aldehyden gegenereerd door peroxidatie of spontane uitdroging van lipide second messengers (Andersson et al., 2008; Cruz-Orengo et al., 2008; Materazzi et al., 2008; Trevisani et al., 2007). Andere endogene TRPA1-agonisten zijn onder meer nitro-oliezuur, waterstofperoxide en waterstofsulfide. Naast deze direct werkende middelen wordt TRPA1 ook indirect gemoduleerd door pro-algetische middelen, zoals bradykinine, die werken via PLC-gekoppelde receptoren. TRPA1-deficiënte muizen vertonen inderdaad dramatisch verminderde cellulaire en gedragsreacties op al deze middelen, evenals een vermindering van door weefselschade opgewekte thermische en mechanische overgevoeligheid (Bautista et al., 2006; Kwan et al., 2006). Ten slotte, omdat TRPA1 een sleutelrol speelt in neurogene en andere ontstekingsreacties op zowel endogene agentia als vluchtige milieutoxines, is de bijdrage ervan aan luchtwegontsteking, zoals die optreedt bij astma, van bijzonder belang. Inderdaad, genetische of farmacologische blokkade van TRPA1 vermindert luchtwegontsteking in een knaagdiermodel van allergeen-opgewekte astma (Caceres et al., 2009).
ASIC's. Zoals hierboven opgemerkt, zijn ASIC-kanalen leden van de DEG / ENaC-familie die worden geactiveerd door aanzuring en dus een andere belangrijke plaats vertegenwoordigen voor de werking van extracellulaire protonen geproduceerd als gevolg van weefselbeschadiging of metabole stress. ASIC-subtypes kunnen een verscheidenheid aan homomere of heteromerische kanalen vormen, elk met een verschillende pH-gevoeligheid en expressieprofiel. Kanalen die het ASIC3-subtype bevatten, worden specifiek tot expressie gebracht door nociceptors en zijn met name goed vertegenwoordigd in vezels die de skelet- en hartspier laten regenereren. In deze weefsels leidt het anaerobe metabolisme tot opbouw van melkzuur en protonen, die nociceptoren activeren om musculoskeletale of hartpijn te genereren (Immke en McCleskey, 2001). Interessant is dat ASIC3-bevattende kanalen openen als reactie op de bescheiden afname van de pH (bijv. 7.4 tot 7.0) die optreedt bij cardiale ischemie (Yagi et al., 2006). Melkzuur versterkt ook aanzienlijk proton-evoked gating door een mechanisme met calciumchelatie (Immke en McCleskey, 2003). Aldus, ASIC3-bevattende kanalen detecteren en integreren signalen die specifiek geassocieerd zijn met spierischemie en, op deze manier, functioneel verschillend van andere zure sensoren op de primaire afferente, zoals TRPV1 of andere ASIC kanaalsubtypen.
Persistent Pain: Central Mechanisms
Centrale sensitisatie verwijst naar het proces waardoor een staat van hyperexcitabiliteit wordt vastgesteld in het centrale zenuwstelsel, wat leidt tot een verbeterde verwerking van nociceptieve (pijn) berichten (Woolf, 1983). Hoewel hier veel mechanismen zijn betrokken bij centrale sensitisatie, concentreren we ons op drie: verandering in glutamaterge neurotransmissie / NMDA receptor-gemedieerde overgevoeligheid, verlies van tonisch-remmende controles (disinhibitie) en gliaal-neuronale interacties (Figuur 5).
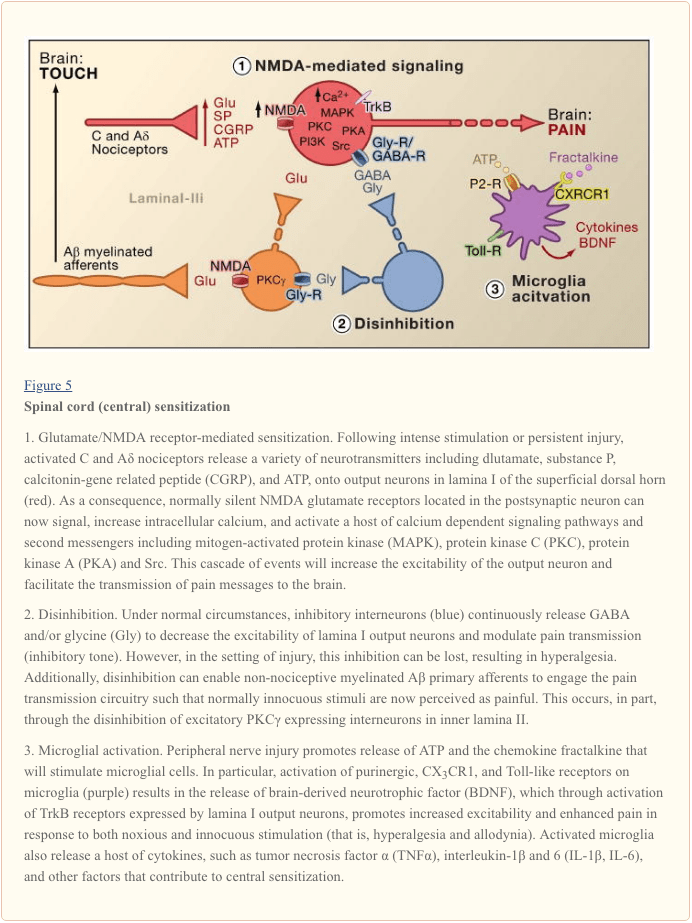
Glutamaat / NMDA Receptor-gemedieerde sensibilisatie
Acute pijn wordt gesignaleerd door de afgifte van glutamaat uit de centrale klemmen van nociceptoren, waarbij exciterende post-synaptische stromen (EPSC's) worden gegenereerd in tweede orde dorsale hoornneuronen. Dit gebeurt voornamelijk door activering van postsynaptische AMPA- en kaïnaatsubtypen van ionotrope glutamaatreceptoren. Opsomming van sub-drempelwaarde-EPSC's in het postsynaptische neuron zal uiteindelijk resulteren in actiepotentiaalvervuring en transmissie van de pijnmelding naar hogere orde neuronen. Onder deze omstandigheden is het NMDA-subtype van het glutamaatkanaal stil, maar in de setting van de verwonding zal een verhoogde afgifte van neurotransmitters uit nociceptoren voldoende postsynaptische neuronen depolariseren om de in ruste NMDA-receptoren te activeren. De daaruit voortvloeiende toename van de calciuminstroom kan de synaptische verbindingen tussen nociceptoren en dorsale hoornpijnoverdrachtseneuronen versterken, wat op zijn beurt de reacties op schadelijke stimuli zal verergeren (dat wil zeggen, hyperalgesie opwekken).
In veel opzichten is dit proces vergelijkbaar met dat betrokken bij de plastische veranderingen geassocieerd met hippocampale langetermijnpotentiëring (LTP) (voor een overzicht van LTP in de pijnroute, zie Drdla en Sandkuhler, 2008). Geneesmiddelen die spinale LTP blokkeren, verminderen inderdaad door weefselbeschadiging veroorzaakte hyperalgesie. Zoals in het geval van LTP in de hippocampus, is de centrale sensitisatie van het ruggenmerg afhankelijk van NMDA-gemedieerde verhogingen van cytosolisch Ca2+ in het postsynaptische neuron. Gelijktijdige activering van metabotrope glutamaat- en substantie P-receptoren op het postsynaptische neuron kan ook bijdragen aan sensibilisatie door cytosolisch calcium te verhogen. Stroomafwaartse activering van een groot aantal signaalroutes en second messenger-systemen, met name kinasen (zoals MAPK, PKA, PKC, PI3K, Src), verhoogt de prikkelbaarheid van deze neuronen verder, gedeeltelijk door de NMDA-receptorfunctie te moduleren (Latremoliere en Woolf, 2009) . Illustratief voor dit model is de demonstratie dat spinale injecties van een peptidefragment van negen aminozuren van Src niet alleen een NMDA-receptor-Src-interactie verstoort, maar ook de overgevoeligheid veroorzaakt door perifere verwonding aanzienlijk vermindert, zonder acute pijn te veranderen. Src nul-mutante muizen vertonen ook verminderde mechanische allodynie na zenuwbeschadiging (Liu et al., 2008).
Naast het verbeteren van de input van de plaats van de verwonding (primaire hyperalgesie), draagt centrale sensibilisatie bij aan de toestand waarin onschadelijke stimulatie van gebieden rond de plaats van de verwonding pijn kan veroorzaken. Deze secundaire hyperalgesie omvat heterosynaptische facilitering, waarbij input van A? afferenten, die normaal reageren op lichte aanraking, schakelen nu pijnoverdrachtscircuits in, wat resulteert in ernstige mechanische allodynie. Het feit dat compressieblokkering van perifere zenuwvezels gelijktijdig de geleiding in A onderbreekt? afferenten en elimineert secundaire hyperalgesie geeft aan dat deze abnormale circuits zowel in klinische omgevingen als in diermodellen tot stand zijn gebracht (Campbell et al., 1988).
Verlies van GABAergic en Glycinergic Controls: Disinhibition
GABAergische of glycinergische remmende interneuronen zijn dicht verspreid in de oppervlakkige dorsale hoorn en vormen de basis van de lang bestaande gate-controletheorie van pijn, die veronderstelt dat verlies van functie van deze remmende interneuronen (ontremming) zou leiden tot verhoogde pijn (Melzack en Wall, 1965). Inderdaad, bij knaagdieren produceert spinale toediening van GABA (bicuculline) of glycine (strychnine) receptorantagonisten (Malan et al., 2002; Sivilotti en Woolf, 1994; Yaksh, 1989) gedragsovergevoeligheid die lijkt op die waargenomen na perifere verwonding. Consistent met deze waarnemingen leidt perifere verwonding tot een afname van remmende postsynaptische stromen in oppervlakkige dorsale hoornneuronen. Hoewel Moore et al. (2002) suggereerde dat de desinhibitie het gevolg is van door perifere zenuwbeschadiging geïnduceerde dood van GABAergic interneuronen, deze bewering is betwist (Polgar et al., 2005). Ongeacht de etiologie verbetert de resulterende verminderde tonische remming de depolarisatie en excitatie van projectie-neuronen. Wat NMDA-gemedieerde centrale sensitisatie betreft, versterkt disinhibitie de productie van het ruggenmerg als reactie op pijnlijke en niet-pijnlijke stimulatie, en draagt het bij aan mechanische allodynie (Keller et al., 2007; Torsney en MacDermott, 2006).
Volgend op een eerder rapport dat schrapping van het gen dat codeert voor PKC? bij de muis leidt tot een duidelijke afname van door zenuwbeschadiging opgewekte mechanische overgevoeligheid (Malmberg et al., 1997), recente studies richten zich op de betrokkenheid van deze neuronen bij het ontremmende proces. Dus, na blokkade van glycinergische remming met strychnine, activeert onschadelijk borstelen van de achterpoot PKC? -Positieve interneuronen in lamina II (Miraucourt et al., 2007), evenals projectie-neuronen in lamina I. ruggenmerg bevinden zich alleen in het binnenste deel van lamina II (figuur 1), hieruit volgt dat deze neuronen essentieel zijn voor de expressie van door zenuwbeschadiging opgewekte aanhoudende pijn, en dat ontremming mechanismen leiden tot hun hyperactivering.
Andere studies geven aan dat veranderingen in het projectie-neuron zelf bijdragen aan het remmende proces. Perifere zenuwbeschadiging reguleert bijvoorbeeld diepgaand de K + -Cl- cotransporter KCC2, die essentieel is voor het handhaven van normale K + en Cl- gradiënten over het plasmamembraan (Coull et al., 2003). Het neerwaarts reguleren van KCC2, dat tot expressie wordt gebracht in lamina I projectie-neuronen, resulteert in een verschuiving in de Cl-gradiënt, zodat activering van GABA-A-receptoren de lamina I projectie-neuronen depolariseert in plaats van hyperpolariseert. Dit zou op zijn beurt de prikkelbaarheid vergroten en de pijnoverdracht vergroten. Inderdaad induceert farmacologische blokkade of siRNA-gemedieerde neerwaartse regulatie van KCC2 bij de rat mechanische allodynie. Niettemin suggereren Zeilhofer en collega's dat, zelfs na een blessure, er voldoende remmende tonus blijft zodat versterking van spinale GABAergische neurotransmissie een waardevolle benadering kan zijn om pijnovergevoeligheid veroorzaakt door perifere zenuwbeschadiging te verminderen (Knabl et al., 2008). Studies bij muizen suggereren zelfs dat geneesmiddelen die specifiek gericht zijn op GABAA-complexen die á 2 en / of á 3 subeenheden bevatten, inflammatoire en neuropathische pijn verminderen zonder sedativum-hypnotische bijwerkingen te veroorzaken die typisch geassocieerd worden met benzodiazepinen, die de activiteit van α1-bevattende kanalen versterken.
Ontremming kan ook optreden door modulatie van glycinergische signalering. In dit geval omvat het mechanisme een werking van het ruggenmerg van prostaglandinen (Harvey et al., 2004). In het bijzonder induceert weefselschade spinale afgifte van prostaglandine, PGE2, dat inwerkt op EP2-receptoren tot expressie gebracht door exciterende interneuronen en projectie-neuronen in de oppervlakkige dorsale hoorn. Resulterende stimulering van de cAMP-PKA-route fosforyleert GlyRa3-glycine-receptorsubeenheden, waardoor de neuronen niet reageren op de remmende effecten van glycine. Dienovereenkomstig hebben muizen die het GlyRa3-gen missen, een verminderde warmte en mechanische hypergevoeligheid in modellen van weefselbeschadiging.
Glial-neuronale interacties
Ten slotte dragen gliacellen, met name microglia en astrocyten, ook bij aan het centrale sensibilisatieproces dat optreedt in de setting van letsel. Onder normale omstandigheden functioneren microglia als residente macrofagen van het centrale zenuwstelsel. Ze zijn homogeen verdeeld in de grijze massa van het ruggenmerg en worden verondersteld te functioneren als schildwachten van letsel of infectie. Binnen enkele uren na perifere zenuwbeschadiging hopen microglia zich echter op in de oppervlakkige dorsale hoorn binnen de eindzone van beschadigde perifere zenuwvezels. Microglia omringen ook de cellichamen van de motorneuronen van de ventrale hoorn, waarvan de perifere axonen gelijktijdig worden beschadigd. De geactiveerde microglia geven een scala aan signaalmoleculen af, waaronder cytokines (zoals TNF- ?, interleukine-1? En 6), die de neuronale centrale sensibilisatie en door zenuwbeschadiging geïnduceerde aanhoudende pijn versterken (DeLeo et al., 2007). Inderdaad, injectie van geactiveerde hersenmicroglia in het hersenvocht ter hoogte van het ruggenmerg kan de gedragsveranderingen na zenuwbeschadiging reproduceren (Coull et al., 2005). Het lijkt er dus op dat microgliale activering voldoende is om de aanhoudende pijnconditie op gang te brengen (Tsuda et al., 2003).
Omdat microglia worden geactiveerd na de zenuw, maar niet door ontstekingsweefselletsel, volgt hieruit dat activering van de afferente vezel, die plaatsvindt onder beide letselomstandigheden, niet de kritische trigger is voor microgliale activering. Integendeel, fysieke beschadiging van de perifere afferent moet de afgifte van specifieke signalen induceren die worden gedetecteerd door microglia. De belangrijkste daarvan is ATP, dat gericht is op microgliale purinerge receptoren van het P2-type. Van bijzonder belang zijn P2X4 (Tsuda et al., 2003), P2X7 (Chessell et al., 2005) en P2Y12 (Haynes et al., 2006; Kobayashi et al., 2008) receptorsubtypen. Inderdaad, ATP werd gebruikt om microglia van de hersenen te activeren in de transplantaties van ruggenmergtransplantaties waarnaar hierboven wordt verwezen (Tsuda et al., 2003). Bovendien voorkomt of keert genetische of farmacologische blokkade van de purinerge receptorfunctie (Chessell et al., 2005; Tozaki-Saitoh et al., 2008; Ulmann et al., 2008) zenuwbeschadiging geïnduceerde mechanische allodynie (Honore et al., 2006) ; Kobayashi et al., 2008; Tozaki-Saitoh et al., 2008; Tsuda et al., 2003).
Coull en collega's stelden een model voor waarin ATP / P2X4-gemedieerde activering van microglia een mechanisme van ontremming veroorzaakt (Coull et al., 2005). Specifiek toonden ze aan dat ATP-opgewekte activering van P2X4-receptoren de afgifte van de van de hersenen afgeleide neurotrofe factor (BDNF) uit microglia induceert. De BDNF, op zijn beurt, werkt in op TrkB-receptoren op lamina I-projectie-neuronen, om een verandering in de Cl-gradiënt te genereren, die, zoals hierboven beschreven, de werking van GABA zou verschuiven van hyperpolarisatie naar depolarisatie. Of het BDNF-geïnduceerde effect KCC2-expressie omvat, zoals optreedt na zenuwbeschadiging, is niet bekend. Ongeacht het mechanisme, het netto resultaat is dat activering van microglia lamina I neuronen zal sensibiliseren zodat hun reactie op monosynaptische input van nociceptoren, of indirecte input van A? afferenten, wordt versterkt.
Behalve BDNF, activeren geactiveerde microglia, zoals perifere macrofagen, en reageren op talrijke chemokinen en cytokinen, en deze dragen ook bij aan centrale sensitisatie. Bijvoorbeeld, in het ongedeerde (normale) dier, wordt de chemokine fractalkine (CXCL1) tot expressie gebracht door zowel primaire afferenten als ruggenmergneuronen (Lindia et al., 2005; Verge et al., 2004; Zhuang et al., 2007). Daarentegen wordt de fractalkinereceptor (CX3CR1) tot expressie gebracht op microgliale cellen en, belangrijker, wordt opgereguleerd na perifere zenuwbeschadiging (Lindia et al., 2005; Zhuang et al., 2007). Omdat spinale toediening van fractalkine microglia kan activeren, lijkt het erop dat zenuwbeschadiging geïnduceerde afgifte van fractalkine nog een andere route biedt waardoor microglia kan worden betrokken bij het proces van centrale sensitisatie. Blokkade van CX3CR1 met een neutraliserend antilichaam voorkomt inderdaad zowel de ontwikkeling als het onderhoud van door schade geïnduceerde aanhoudende pijn (Milligan et al., 2004; Zhuang et al., 2007). Deze route kan ook deel uitmaken van een positieve feedbacklus waardoor gekwetste zenuwvezels en microgliale cellen interageren op een reciproke en recurrente manier om pijnsignalen te versterken. Dit punt wordt onderstreept door het feit dat fractalkine voorafgaand aan signalering van het neuronale oppervlak moet worden gesplitst, een actie die wordt uitgevoerd door het van microglia afgeleide protease, cathepsine S, waarvan remmers de door zenuwbeschadiging geïnduceerde allodynie en hyperalgesie verminderen (Clark et al. al., 2007). Belangrijk is dat spinale toediening van cathepsine S gedragsovergevoeligheid veroorzaakt bij wildtype, maar niet bij CX3CX1 knockout-muizen, waarbij cathepsine S wordt gekoppeld aan fractalkinesignalering (Clark et al., 2007; Zhuang et al., 2007). Hoewel de factor (en) die de afgifte van cathepsine S uit microglia initieert nog moet worden bepaald. ATP lijkt een redelijke mogelijkheid.
Zeer recent zijn verschillende leden van de Toll-like receptoren (TLR's) familie ook betrokken bij de activering van microglia na zenuwbeschadiging. TLR's zijn transmembraansignaleringseiwitten die tot expressie worden gebracht in perifere immuuncellen en glia. Als onderdeel van het aangeboren immuunsysteem herkennen ze moleculen die in grote lijnen worden gedeeld door pathogenen. Genetische of farmacologische remming van de TLR2-, TLR3- of TLR4-functie bij muizen resulteert niet alleen in verminderde microgliale activering, maar vermindert ook de overgevoeligheid veroorzaakt door perifere zenuwbeschadiging (Kim et al., 2007; Obata et al., 2008; Tanga et al. , 2005). Onbekend zijn de endogene liganden die TLR2-4 activeren na zenuwbeschadiging. Onder de kandidaten bevinden zich mRNA's of heat shock-eiwitten die kunnen lekken van de beschadigde primaire afferente neuronen en diffunderen in het extracellulaire milieu van het ruggenmerg.
De bijdrage van astrocyten aan centrale sensitisatie is minder duidelijk. Astrocyten worden onbetwistbaar geïnduceerd in het ruggenmerg na verwonding van weefsel of zenuw (voor een overzicht, zie Ren en Dubner, 2008). Maar, in tegenstelling tot microglia, wordt astrocytactivering over het algemeen vertraagd en blijft veel langer bestaan, tot enkele maanden. Een interessante mogelijkheid is dat astrocyten meer kritisch zijn voor het onderhoud dan voor de inductie van centrale sensitisatie en aanhoudende pijn.
Ten slotte is het vermeldenswaardig dat perifere verwonding niet alleen glia in het ruggenmerg activeert, maar ook in de hersenstam, waar Glia bijdraagt aan supraspinale faciliterende invloeden op de verwerking van pijnberichten in het ruggenmerg (zie figuur 2), een fenomeen genaamd aflopende facilitation (voor een bespreking, zie Ren en Dubner, 2008). Een dergelijke facilitering is vooral prominent in het stellen van letsel en lijkt de feedback-remmende controles die gelijktijdig ontstaan uit verschillende loci van de hersenstam tegen te gaan (Porreca et al., 2002).

Insight van Dr. Alex Jimenez
Zoals vastgesteld door de Internationale Associatie voor de Studie van Pijn, of de IASP, is pijn "een onplezierige sensorische en emotionele ervaring geassocieerd met acute of potentiële weefselbeschadiging, of beschreven in termen van weefselbeschadiging of beide. Talloze onderzoeksstudies zijn voorgesteld om de fysiologische basis van pijn aan te tonen, maar niemand heeft de volledige aspecten die verband houden met pijnperceptie kunnen omvatten. Het begrijpen van de pijnmechanismen van acute pijn versus chronische pijn is van fundamenteel belang tijdens klinische evaluaties, omdat dit kan helpen bij het bepalen van de beste behandelmethode voor patiënten met onderliggende gezondheidsproblemen.
Specificiteit in het verzenden en beheersen van pijnberichten
Begrijpen hoe stimuli door het zenuwstelsel worden gecodeerd om passend gedrag uit te lokken, is van fundamenteel belang voor de studie van alle sensorische systemen. In de eenvoudigste vorm gebruikt een zintuiglijk systeem gelabelde lijnen om prikkels om te zetten en gedrag op te wekken via strikt gescheiden circuits. Dit wordt misschien het best geïllustreerd door het smaaksysteem, waar het verwisselen van een zoete receptor voor een bittere in een populatie van "zoete smaakafferenten" het gedrag veroorzaakt door activiteit in die gelabelde lijn niet verandert; onder deze omstandigheden stimuleert een bittere smaak deze afferenten om een perceptie van zoetheid op te wekken (Mueller et al., 2005).
In het pijnpad is er ook bewijs dat het bestaan van gelabelde lijnen ondersteunt. Zoals hierboven vermeld, worden warmte en koude gedetecteerd door grotendeels verschillende subsets van primaire afferente vezels. Bovendien kan eliminatie van subsets van nociceptoren selectieve tekortkomingen in de gedragsreactie op een bepaalde schadelijke modaliteit veroorzaken. De vernietiging van nociceptoren die TRPV1 tot expressie brengen, veroorzaakt bijvoorbeeld een aanzienlijk verlies van hittepijn (inclusief hyperalgesie van hitte), zonder verandering in gevoeligheid voor pijnlijke mechanische of koude stimuli. Omgekeerd resulteert deletie van de MrgprD-subset van nociceptoren in een zeer selectieve tekortkoming in mechanische responsiviteit, zonder verandering in warmtegevoeligheid (Cavanaugh et al., 2009). Verder bewijs voor functionele segregatie op het niveau van de nociceptor is afkomstig van de analyse van twee verschillende opioïde receptor-subtypes (Scherrer et al., 2009). Specifiek overheerst de mu-opioïde receptor (MOR) in de peptidergische populatie, terwijl de delta-opioïde receptor (DOR) tot expressie wordt gebracht in niet-peptidergische nociceptoren. MOR-selectieve agonisten blokkeren hittepijn, terwijl DOR-selectieve agonisten mechanische pijn blokkeren, wat wederom de functionele scheiding van moleculair verschillende nociceptorpopulaties illustreert.
Deze waarnemingen pleiten voor gedragsrelevante specificiteit op het niveau van de nociceptor. Dit zal echter om ten minste twee redenen een te grote vereenvoudiging zijn. Ten eerste zijn veel nociceptoren polymodaal en kunnen daarom worden geactiveerd door thermische, mechanische of chemische stimuli, waardoor men zich afvraagt hoe eliminatie van grote cohorten nociceptoren modaliteitspecifieke effecten kunnen hebben. Dit pleit voor een substantiële bijdrage van spinale circuits aan het proces waarbij nociceptieve signalen worden gecodeerd in verschillende pijnmodaliteiten. Een belangrijk toekomstig doel is inderdaad om neuronale subtypen beter af te bakenen binnen de dorsale hoorn en hun synaptische interacties met functioneel of moleculair gedefinieerde subpopulaties van nociceptoren te karakteriseren. Ten tweede vertoont het pijnsysteem een enorm vermogen tot verandering, met name bij het vaststellen van letsel, en roept het vragen op over of en hoe een gelabeld lijnensysteem geschikt is voor dergelijke plasticiteit, en hoe veranderingen in dergelijke mechanismen ten grondslag liggen aan onaangepaste veranderingen die chronische pijn veroorzaken. We weten inderdaad dat substantie P-saporine-gemedieerde deletie van een afzonderlijke populatie van lamina I dorsale hoornneuronen, die de substantie P-receptor tot expressie brengen, zowel de thermische als mechanische pijnovergevoeligheid kan verminderen die optreedt na weefsel- of zenuwbeschadiging (Nichols et al. ., 1999). Dergelijke observaties suggereren dat in de setting van letselspecificiteit van de gelabelde lijn niet strikt wordt gehandhaafd omdat informatie wordt overgedragen naar hogere niveaus van de neuraxis.
Het is duidelijk dat antwoorden op deze vragen het gecombineerde gebruik van anatomische, elektrofysiologische en gedragsmatige methoden vereisen om het fysieke en functionele circuit in kaart te brengen dat ten grondslag ligt aan nociceptie en pijn. De voortdurende identificatie van moleculen en genen die specifieke neuronale celtypes markeren (zowel perifeer als centraal) biedt essentiële hulpmiddelen om deze neuronen genetisch of farmacologisch te manipuleren en hun activiteiten te koppelen aan specifieke componenten van pijngedrag onder normale en pathofysiologische omstandigheden. Dit zou ons dichter bij het begrip moeten brengen hoe acute pijn plaats maakt voor de onaangepaste veranderingen die chronische pijn veroorzaken, en hoe deze omschakeling kan worden voorkomen of omgekeerd.

Hennep versus marihuana: wat is het verschil?
Nu ongeveer de helft van de Amerikaanse staten de verkoop van medicinale marihuana toestaat en enkelen zelfs de verkoop van marihuana voor recreatief gebruik toestaan, raken steeds meer mensen geïnteresseerd in de mogelijke gezondheidsvoordelen van deze controversiële plant.
Terwijl de wetenschap over haar medische gebruik blijft toenemen, overwegen veel mensen tegenwoordig hoe ze toegang kunnen krijgen tot de gezondheidsvoordelen van de plant zonder het bekende ongewenste psychoactieve effect te ervaren. Dit is volledig mogelijk met de naaste familie van marihuana, hennep, maar het is essentieel dat je je bewust bent van het verschil, zodat je een slimme consument kunt zijn.
Een cultivar van de Exact Same Plant
Fundamenteel zijn zowel hennep als marihuana exact dezelfde plant: Cannabis sativa. Er zijn aanwijzingen dat Cannabis sativa L duizenden jaren geleden in Azië is geteeld voor zijn vezels en als voedselbron. Mensen beseften uiteindelijk dat de bloeiende toppen van de plant psychoactieve eigenschappen hadden. Met de tijd, zoals mensen dat met veel andere planten hebben gedaan, begonnen cannabiskwekers specifieke planten te kweken om specifieke eigenschappen te verbeteren.
Tegenwoordig zijn er, hoewel sommigen misschien het ware aantal plantentypen betogen, eigenlijk twee simpele onderscheidingen,
Hennep - Een plant die voornamelijk buiten de Verenigde Staten wordt geteeld, hoewel een aantal Amerikaanse landen het voor studiedoeleinden laten verbouwen) voor gebruik in kleding, papier, biobrandstoffen, biokunststoffen, voedingssupplementen, cosmetica en voedingsmiddelen. Hennep wordt buiten gekweekt als een groot gewas, waarbij zowel mannelijke als vrouwelijke planten aanwezig zijn om de bestuiving te bevorderen en de zaadproductie te verbeteren. Legaal geïmporteerde industriële hennep bevat minder dan 0.3 procent van zijn kankerverwekkende chemische tetrahydrocannabinol- of THC-inhoud. In de praktijk zal legaal geïmporteerde hennep gewoonlijk alle extracten in de gedroogde bloeiende toppen van de plant elimineren.
Marihuana (Marihuana) - Cannabis sativa, speciaal gekweekt om het THC-gehalte te verhogen voor medicinale of recreatieve doeleinden. Marihuanaplanten worden doorgaans binnenshuis gekweekt, onder gecontroleerde omstandigheden en telers elimineren alle mannelijke planten uit de oogst om bevruchting te voorkomen, omdat bemesting de THC-graad van de plant verlaagt.
Legaliteit van medische marihuana
Het medische gebruik van marihuana is een groter controversieel onderwerp voor zowel onderzoekers als consumenten. Hoewel misschien niet de helft van de Amerikaanse staten het medische gebruik van deze plant heeft gelegaliseerd, blijft het volgens de federale wetgeving illegaal en bijgevolg blijft het gebruik ervan controversieel, ongeacht het feit dat er inderdaad gezondheidsvoordelen zijn voor verschillende ernstige gezondheidskwesties.
Degenen die marihuana willen gebruiken voor medisch gebruik, moeten over de voordelen ervan en de gevaren praten met een bekwame beroepsbeoefenaar in de gezondheidszorg voordat deze wordt gebruikt. Bovendien hebben veel consumenten die belang hebben bij de gezondheidsvoordelen niet de psychoactieve bijwerkingen van THC of het gevaar van een positieve drugstest nodig.
Hennep: gezondheidsvoordelen zonder de risico's
Geïmporteerde hennep, die een zeer laag, bijna afwezig, THC-gehalte heeft, kan een oplossing zijn voor consumenten die op zoek zijn naar de gezondheidsvoordelen van de plant minus de effecten van THC.
Hoewel THC bepaalde gezondheidsvoordelen heeft, bevat hennep meer dan 80-bioactieve stoffen die een uitstekende ondersteuning kunnen bieden voor een reeks gezondheidsproblemen, zoals stressreactie, positieve stemming en fysiek ongemak of pijn. Hennep kan ook de gastro-intestinale gezondheid ten goede komen, een gezonde ontstekingsreactie in het hele lichaam helpen behouden en een normale immuunfunctie ondersteunen.
Als u overweegt het gebruik van een voedingssupplementproduct dat hennep bevat, dan is het ideaal om een product bij een vertrouwde bron te kopen.
Concluderend zowel het perifere als het centrale zenuwstelsel detecteren, interpreteren en reguleren een breed scala aan thermische en mechanische stimulatie, evenals omgevings- en endogene chemische irriterende stoffen. Als de prikkels te intens zijn, kan het acute pijn veroorzaken, waarbij in geval van aanhoudende of chronische pijn de pijnoverdracht enorm kan worden beïnvloed. Het bovenstaande artikel beschrijft de cellulaire en moleculaire mechanismen van pijn als leidraad bij klinische beoordelingen. Bovendien kan het gebruik van hennep veel gezondheidsvoordelen hebben in vergelijking met de controversiële effecten van marihuana. Informatie waarnaar wordt verwezen door het National Center for Biotechnology Information (NCBI). De reikwijdte van onze informatie is beperkt tot chiropractie en rugletsel en aandoeningen. Om het onderwerp te bespreken, kunt u het aan Dr. Jimenez vragen of contact met ons opnemen via 915-850-0900 .
Curator van Dr. Alex Jimenez
Abrahamsen B, Zhao J, Asante CO, Cendan CM, Marsh S, Martinez-Barbera JP, Nassar MA, Dickenson AH, Wood JN. De cel- en moleculaire basis van mechanische, koude en inflammatoire pijn. Wetenschap. 2008;321:702-705. [PubMed]
Akopian AN, Souslova V, Engeland S, Okuse K, Ogata N, Ure J, Smith A, Kerr BJ, McMahon SB, Boyce S, et al. Het tetrodotoxine-resistente natriumkanaal SNS heeft een gespecialiseerde functie in pijnpaden. Nat Neurosci. 1999;2:541-548. [PubMed]
Alessandri-Haber N, Dina OA, Joseph EK, Reichling D, Levine JD. Een tijdelijk receptorpotentieel vanilloïde 4-afhankelijk mechanisme van hyperalgesie wordt geactiveerd door een gezamenlijke actie van ontstekingsmediatoren. J Neurosci. 2006;26:3864-3874. [PubMed]
Andersson DA, Gentry C, Moss S, Bevan S. Tijdelijk receptorpotentieel A1 is een sensorische receptor voor meerdere producten van oxidatieve stress. J Neurosci. 2008;28:2485–2494. [PMC gratis artikel] [PubMed]
Apkarian AV, Bushnell MC, Treede RD, Zubieta JK. Menselijke hersenmechanismen van pijnperceptie en -regulatie bij gezondheid en ziekte. Eur J Pijn. 2005;9:463-484. [PubMed]
Attal N, Bouhassira D, Gautron M, Vaillant JN, Mitry E, Lepere C, Rougier P, Guirimand F. Thermische hyperalgesie als een marker van oxaliplatine-neurotoxiciteit: een prospectieve gekwantificeerde sensorische beoordelingsstudie. Pijn. 2009;144:245–252. [PubMed]
Atzeni F, Turiel M, Capsoni F, Doria A, Meroni P, Sarzi-Puttini P. Auto-immuniteit en anti-TNF-alfa-middelen. Ann NY Acad Sci. 2005; 1051: 559-569. [PubMed]
Bandell M, Story GM, Hwang SW, Viswanath V, Eid SR, Petrus MJ, Earley TJ, Patapoutian A. Het schadelijke koude ionenkanaal TRPA1 wordt geactiveerd door penetrante verbindingen en bradykinine. neuron. 2004;41:849-857. [PubMed]
Basbaum AI, Jessell T. De perceptie van pijn. In: Kandel ER, Schwartz J, Jessell T, redacteuren. Principes van neurowetenschap. New York: Appleton en Lange; 2000. blz. 472-491.
Bautista DM, Jordt SE, Nikai T, Tsuruda PR, Read AJ, Poblete J, Yamoah EN, Basbaum AI, Julius D. TRPA1 bemiddelt de ontstekingsacties van irriterende stoffen in de omgeving en proalgetische middelen. Cel. 2006;124:1269-1282. [PubMed]
Bautista DM, Siemens J, Glazer JM, Tsuruda PR, Basbaum AI, Stucky CL, Jordt SE, Julius D. De mentholreceptor TRPM8 is de belangrijkste detector van omgevingskou. Natuur. 2007;448:204-208. [PubMed]
Bautista DM, Sigal YM, Milstein AD, Garrison JL, Zorn JA, Tsuruda PR, Nicoll RA, Julius D. Scherpe middelen van Szechuan-pepers prikkelen sensorische neuronen door kaliumkanalen met twee poriën te remmen. Nat Neurosci. 2008;11:772-779. [PMC gratis artikel] [PubMed]
Bessac BF, Jordt SE. Adembenemende TRP-kanalen: TRPA1 en TRPV1 in chemosensatie van de luchtwegen en reflexcontrole. Fysiologie (Bethesda) 2008; 23: 360-370. [PMC gratis artikel] [PubMed]
Bhattacharya MR, Bautista DM, Wu K, Haeberle H, Lumpkin EA, Julius D. Radiale rek onthult verschillende populaties van mechanosensitieve somatosensorische neuronen van zoogdieren. Proc Natl Acad Sci VS A. 2008;105:20015–20020. [PMC gratis artikel] [PubMed]
Brown DA, Passmore GM. Neurale KCNQ (Kv7) kanalen. BrJ Pharmacol. 2009; 156: 1185-1195. [PMC gratis artikel] [PubMed]
Bryant BP, Mezine I. Alkylamiden die tintelende paresthesie produceren, activeren tactiele en thermische trigeminusneuronen. Hersenonderzoek. 1999;842:452-460. [PubMed]
Caceres AI, Brackmann M, Elia MD, Bessac BF, del Camino D, D'Amours M, Witek JS, Fanger CM, Chong JA, Hayward NJ, et al. Een sensorisch neuronaal ionkanaal dat essentieel is voor luchtwegontsteking en hyperreactiviteit bij astma. Proc Natl Acad Sci VS A. 2009;106:9099-9104. [PMC gratis artikel] [PubMed]
Campbell JN, Raja SN, Meyer RA, Mackinnon SE. Gemyeliniseerde afferenten signaleren de hyperalgesie geassocieerd met zenuwbeschadiging. Pijn. 1988;32:89-94. [PubMed]
Cao YQ. Spanningsafhankelijke calciumkanalen en pijn. Pijn. 2006;126:5-9. [PubMed]
Caterina MJ, Leffler A, Malmberg AB, Martin WJ, Trafton J, Petersen-Zeitz KR, Koltzenburg M, Basbaum AI, Julius D. Verminderde nociceptie en pijnsensatie bij muizen zonder de capsaïcine-receptor. Wetenschap. 2000;288:306-313. [PubMed]
Caterina MJ, Rosen TA, Tominaga M, Brake AJ, Julius D. Een capsaïcine-receptor-homoloog met een hoge drempel voor schadelijke hitte. Natuur. 1999;398:436-441. [PubMed]
Caterina MJ, Schumacher MA, Tominaga M, Rosen TA, Levine JD, Julius D. De capsaïcine-receptor: een door warmte geactiveerd ionkanaal in de pijnroute. Natuur. 1997;389:816-824. [PubMed]
Cavanaugh DJ, Lee H, Lo L, Shields SD, Zylka MJ, Basbaum AI, Anderson DJ. Verschillende subsets van niet-gemyeliniseerde primaire sensorische vezels mediëren gedragsreacties op schadelijke thermische en mechanische stimuli. Proc Natl Acad Sci VS A. 2009;106:9075-9080. [PMC gratis artikel] [PubMed]
Cesare P, McNaughton P. Een nieuwe door warmte geactiveerde stroom in nociceptieve neuronen en de sensibilisatie ervan door bradykinine. Proc Natl Acad Sci VS A. 1996; 93: 15435-15439. [PMC gratis artikel] [PubMed]
Chalfie M. Neurosensorische mechanotransductie. Nat Rev Mol Cell Biol. 2009;10:44-52. [PubMed]
Chao MV. Neurotrofinen en hun receptoren: een convergentiepunt voor veel signaalroutes. Nat Rev Neurosci. 2003;4:299-309. [PubMed]
Chen L, Huang LY. Eiwitkinase C vermindert Mg2+-blokkering van NMDA-receptorkanalen als een modulatiemechanisme. Natuur. 1992; 356: 521-523. [PubMed]
Chen X, Alessandri-Haber N, Levine JD. Gemarkeerde verzwakking van inflammatoire mediator-geïnduceerde C-fiber sensitisatie voor mechanische en hypotone stimuli in TRPV4 - / - muizen. Mol Pain. 2007, 3: 31. [PMC gratis artikel] [PubMed]
Chessell IP, Hatcher JP, Bountra C, Michel AD, Hughes JP, Green P, Egerton J, Murfin M, Richardson J, Peck WL, et al. Verstoring van het P2X7-purinoceptor-gen heft chronische inflammatoire en neuropathische pijn op. Pijn. 2005;114:386-396. [PubMed]
Cho H, Koo JY, Kim S, Park SP, Yang Y, Oh U. Een nieuw mechanisch gevoelig kanaal geïdentificeerd in sensorische neuronen. Eur J Neurosci. 2006;23:2543-2550. [PubMed]
Cho H, Shin J, Shin CY, Lee SY, Oh U. Mechanosensitieve ionkanalen in gekweekte sensorische neuronen van neonatale ratten. J Neurosci. 2002;22:1238–1247. [PubMed]
Chuang HH, Prescott ED, Kong H, Shields S, Jordt SE, Basbaum AI, Chao MV, Julius D. Bradykinine en zenuwgroeifactor maken de capsaïcine-receptor vrij van PtdIns(4,5)P2-gemedieerde remming. Natuur. 2001;411:957-962. [PubMed]
Chung MK, Lee H, Caterina MJ. Warme temperaturen activeren TRPV4 in muis 308 keratinocyten. J Biol Chem. 2003;278:32037-32046. [PubMed]
Clark AK, Yip PK, Grist J, Gentry C, Staniland AA, Marchand F, Dehvari M, Wotherspoon G, Winter J, Ullah J, et al. Remming van spinale microgliale cathepsine S voor de omkering van neuropathische pijn. Proc Natl Acad Sci VS A. 2007; 104: 10655-10660. [PMC gratis artikel] [PubMed]
Colburn RW, Lubin ML, Stone DJ, Jr, Wang Y, Lawrence D, D'Andrea MR, Brandt MR, Liu Y, Flores CM, Qin N. Verzwakte koudegevoeligheid bij TRPM8-nulmuizen. neuron. 2007;54:379-386. [PubMed]
Coull JA, Beggs S, Boudreau D, Boivin D, Tsuda M, Inoue K, Gravel C, Salter MW, De Koninck Y. BDNF van microglia veroorzaakt de verschuiving in de neuronale aniongradiënt die ten grondslag ligt aan neuropathische pijn. Natuur. 2005;438:1017-1021. [PubMed]
Coull JA, Boudreau D, Bachand K, Prescott SA, Nault F, Sik A, De Koninck P, De Koninck Y. Trans-synaptische verschuiving in aniongradiënt in spinale lamina I-neuronen als een mechanisme van neuropathische pijn. Natuur. 2003;424:938–942. [PubMed]
Cox JJ, Reimann F, Nicholas AK, Thornton G, Roberts E, Springell K, Karbani G, Jafri H, Mannan J, Raashid Y, et al. Een SCN9A-channelopathie veroorzaakt een aangeboren onvermogen om pijn te ervaren. Natuur. 2006;444:894-898. [PubMed]
Cruz-Orengo L, Dhaka A, Heuermann RJ, Young TJ, Montana MC, Cavanaugh EJ, Kim D, Story GM. Cutane nociceptie opgeroepen door 15-delta PGJ2 via activering van ionenkanaal TRPA1. Mol Pain. 2008, 4: 30. [PMC gratis artikel] [PubMed]
Davies A, Hendrich J, Van Minh AT, Wratten J, Douglas L, Dolphin AC. Functionele biologie van de alfa (2) delta-subeenheden van spanningsafhankelijke calciumkanalen. Trends Pharmacol Sci. 2007;28:220-228. [PubMed]
Davis JB, Gray J, Gunthorpe MJ, Hatcher JP, Davey PT, Overend P, Harries MH, Latcham J, Clapham C, Atkinson K, et al. Vanilloïde receptor-1 is essentieel voor inflammatoire thermische hyperalgesie. Natuur. 2000; 405: 183-187. [PubMed]
DeLeo JA, Sorkin LS, Watkins LR, redacteuren. Immuun- en gliale regulatie van pijn. IASP; Seattle: 2007.
de Vries B, Frants RR, Ferrari MD, van den Maagdenberg AM. Moleculaire genetica van migraine. Hum Genet. 2009;126: 115-132. [PubMed]
Dhaka A, Murray AN, Mathur J, Earley TJ, Petrus MJ, Patapoutian A. TRPM8 is vereist voor koude sensatie bij muizen. neuron. 2007;54:371-378. [PubMed]
Dib-Hajj SD, Yang Y, Waxman SG. Genetica en moleculaire pathofysiologie van Na(v)1.7-gerelateerde pijnsyndromen. Ad Genet. 2008;63:85-110. [PubMed]
Dick IE, Brochu RM, Purohit Y, Kaczorowski GJ, Martin WJ, Priest BT. Natriumkanaalblokkade kan bijdragen aan de analgetische werkzaamheid van antidepressiva. J Pijn. 2007;8:315-324. [PubMed]
Dobler TM, Springauf A, Tovornik S, Weber M, Schmitt A, Sedlmeier R, Wischmeyer E, Doring F. TRESK K + -kanalen met twee poriën vormen een significante component van achtergrondkaliumstromen in DRG-neuronen van muizen. J Physiol 2007 [PMC gratis artikel] [PubMed]
Dong X, Han S, Zylka MJ, Simon MI, Anderson DJ. Een diverse familie van GPCR's uitgedrukt in specifieke subsets van nociceptieve sensorische neuronen. Cel. 2001;106:619-632. [PubMed]
Drdla R, Sandkuhler J. Versterking op lange termijn bij C-fibre synapsen door laag-niveau presynaptische activiteit in vivo. Mol Pain. 2008, 4: 18. [PMC gratis artikel] [PubMed]
Drew LJ, Rohrer DK, Price MP, Blaver KE, Cockayne DA, Cesare P, Wood JN. Zuurgevoelige ionenkanalen ASIC2 en ASIC3 dragen niet bij aan mechanisch geactiveerde stromen in sensorische neuronen van zoogdieren. J Fysiol. 2004;556:691-710. [PMC gratis artikel] [PubMed]
Drew LJ, Wood JN, Cesare P. Onderscheidende mechanosensitieve eigenschappen van capsaicinegevoelige en -gevoelige sensorische neuronen. J Neurosci. 2002, 22: RC228. [PubMed]
Estacion M, Dib-Hajj SD, Benke PJ, Te Morsche RH, Eastman EM, Macala LJ, Drenth JP, Waxman SG. NaV1.7 gain-of-function-mutaties als een continuüm: A1632E vertoont fysiologische veranderingen geassocieerd met erytromelalgie en paroxismale extreme pijnstoornis-mutaties en veroorzaakt symptomen van beide aandoeningen. J Neurosci. 2008;28:11079–11088. [PubMed]
Fertleman CR, Baker MD, Parker KA, Moffatt S, Elmslie FV, Abrahamsen B, Ostman J, Klugbauer N, Wood JN, Gardiner RM, et al. SCN9A-mutaties bij paroxysmale extreme pijnstoornis: allele varianten liggen ten grondslag aan verschillende kanaaldefecten en fenotypes. neuron. 2006;52:767-774. [PubMed]
Gevaert T, Vriens J, Segal A, Everaerts W, Roskams T, Talavera K, Owsianik G, Liedtke W, Daelemans D, Dewachter I, et al. Deletie van het tijdelijke receptorpotentieel kationkanaal TRPV4 schaadt de mictie van de blaas bij de muis. J Clin Invest. 2007;117:3453-3462. [PMC gratis artikel] [PubMed]
Grant AD, Cottrell GS, Amadesi S, Trevisani M, Nicoletti P, Materazzi S, Altier C, Cenac N, Zamponi GW, Bautista-Cruz F, et al. Door protease geactiveerde receptor 2 maakt het tijdelijke receptorpotentieel vanilloid 4 ionkanaal gevoelig om mechanische hyperalgesie bij muizen te veroorzaken. J Fysiol. 2007;578:715-733. [PMC gratis artikel] [PubMed]
Guler AD, Lee H, Iida T, Shimizu I, Tominaga M, Caterina M. Door warmte opgewekte activering van het ionenkanaal, TRPV4. J Neurosci. 2002;22:6408-6414. [PubMed]
Harvey RJ, Depner UB, Wassle H, Ahmadi S, Heindl C, Reinold H, Smart TG, Harvey K, Schutz B, Abo-Salem OM, et al. GlyR alpha3: een essentieel doelwit voor spinale PGE2-gemedieerde inflammatoire pijnsensibilisatie. Wetenschap. 2004;304:884-887. [PubMed]
Haynes SE, Hollopeter G, Yang G, Kurpius D, Dailey ME, Gan WB, Julius D. De P2Y12-receptor reguleert microgliale activering door extracellulaire nucleotiden. Nat Neurosci. 2006;9:1512–1519. [PubMed]
Hensel H, Zotterman Y. Het effect van menthol op de thermoreceptoren. Acta Physiol Scan. 1951;24:27-34. [PubMed]
Hefti FF, Rosenthal A, Walicke PA, Wyatt S, Vergara G, Shelton DL, Davies AM. Nieuwe klasse van pijnstillers gebaseerd op antagonisme van NGF. Trends Pharmacol Sci. 2006;27:85-91. [PubMed]
Hensel H, Zotterman Y. Het effect van menthol op de thermoreceptoren. Acta Physiol Scan. 1951;24:27-34. [PubMed]
Hill K, Schaefer M. TRPA1 wordt differentieel gemoduleerd door de amfipathische moleculen trinitrofenol en chloorpromazine. J Biol Chem. 2007;282:7145-7153. [PubMed]
Hinman A, Chuang HH, Bautista DM, Julius D. TRP-kanaalactivering door omkeerbare covalente modificatie. Proc Natl Acad Sci VS A. 2006;103:19564-19568. [PMC gratis artikel] [PubMed]
Honore P, Chandran P, Hernandez G, Gauvin DM, Mikusa JP, Zhong C, Joshi SK, Ghilardi JR, Sevcik MA, Fryer RM, et al. Herhaalde dosering van ABT-102, een krachtige en selectieve TRPV1-antagonist, versterkt TRPV1-gemedieerde analgetische activiteit bij knaagdieren, maar verzwakt door antagonisten geïnduceerde hyperthermie. Pijn. 2009;142:27-35. [PubMed]
Honore P, Donnelly-Roberts D, Namovic MT, Hsieh G, Zhu CZ, Mikusa JP, Hernandez G, Zhong C, Gauvin DM, Chandran P, et al. A-740003 [N-(1-{[(cyanoimino)(5-chinolinylamino)methyl]amino}-2,2-dimethylpropyl)-2-(3,4-dimethoxyfenyl)aceetamide], een nieuwe en selectieve P2X7-receptorantagonist , vermindert dosisafhankelijk neuropathische pijn bij de rat. J Pharmacol Exp Ther. 2006;319:1376-1385. [PubMed]
Hu J, Lewin GR. Mechanosensitieve stromen in de neurieten van gekweekte sensorische neuronen van muizen. J Fysiol. 2006;577:815-828. [PMC gratis artikel] [PubMed]
Immke DC, McCleskey EW. Lactaat versterkt het zuurgevoelige Na+-kanaal op ischemiegevoelige neuronen. Nat Neurosci. 2001;4:869-870. [PubMed]
Immke DC, McCleskey EW. Protonen openen zuurgevoelige ionenkanalen door verlichting van Ca2+-blokkade te katalyseren. neuron. 2003;37:75-84. [PubMed]
Ji RR, Samad TA, Jin SX, Schmoll R, Woolf CJ. p38 MAPK-activering door NGF in primaire sensorische neuronen na ontsteking verhoogt TRPV1-niveaus en handhaaft hittehyperalgesie. neuron. 2002;36:57-68. [PubMed]
Jordt SE, Bautista DM, Chuang HH, McKemy DD, Zygmunt PM, Hogestatt ED, Meng ID, Julius D. Mosterdoliën en cannabinoïden prikkelen sensorische zenuwvezels via het TRP-kanaal ANKTM1. Natuur. 2004;427:260-265. Epub 2004 januari 2007. [PubMed]
Julius D, Basbaum AI. Moleculaire mechanismen van nociceptie. Natuur. 2001;413:203-210. [PubMed]
Karashima Y, Damann N, Prenen J, Talavera K, Segal A, Voets T, Nilius B. Bimodale werking van menthol op het tijdelijke receptorpotentiaalkanaal TRPA1. J Neurosci. 2007;27:9874-9884. [PubMed]
Karashima Y, Talavera K, Everaerts W, Janssens A, Kwan KY, Vennekens R, Nilius B, Voets T. TRPA1 fungeert als een koudesensor in vitro en in vivo. Proc Natl Acad Sci VS A. 2009;106:1273–1278. [PMC gratis artikel] [PubMed]
Kawasaki Y, Kohno T, Zhuang ZY, Brenner GJ, Wang H, Van Der Meer C, Befort K, Woolf CJ, Ji RR. Ionotrope en metabotrope receptoren, proteïnekinase A, proteïnekinase C en Src dragen bij aan door C-vezel geïnduceerde ERK-activering en cAMP-responselement-bindende eiwitfosforylering in dorsale hoornneuronen, wat leidt tot centrale sensitisatie. J Neurosci. 2004;24:8310-8321. [PubMed]
Keller AF, Beggs S, Salter MW, De Koninck Y. Transformatie van de output van spinale lamina I neuronen na zenuwbeschadiging en microglia-stimulatie die ten grondslag ligt aan neuropathische pijn. Mol Pain. 2007, 3: 27. [PMC gratis artikel] [PubMed]
Kim D, Kim MA, Cho IH, Kim MS, Lee S, Jo EK, Choi SY, Park K, Kim JS, Akira S, et al. Een cruciale rol van toll-like receptor 2 bij door zenuwbeschadiging geïnduceerde activering van gliacellen in het ruggenmerg en overgevoeligheid voor pijn. J Biol Chem. 2007;282:14975-14983. [PubMed]
Kindt KS, Viswanath V, Macpherson L, Quast K, Hu H, Patapoutian A, Schafer WR. Caenorhabditis elegans TRPA-1 functioneert bij mechanosensatie. Nat Neurosci. 2007;10:568-577. [PubMed]
Kirschstein T, Busselberg D, Treede RD. Co-expressie van door warmte opgewekte en door capsaïcine opgewekte binnenwaartse stromingen in acuut gedissocieerde dorsale wortelganglionneuronen van de rat. Neurosci Lett. 1997;231:33-36. [PubMed]
Knabl J, Witschi R, Hosl K, Reinold H, Zeilhofer UB, Ahmadi S, Brockhaus J, Sergejeva M, Hess A, Brune K, et al. Omkering van pathologische pijn door specifieke spinale GABAA-receptorsubtypen. Natuur. 2008;451:330-334. [PubMed]
Kobayashi K, Yamanaka H, Fukuoka T, Dai Y, Obata K, Noguchi K. P2Y12-receptor-upregulatie in geactiveerde microglia is een toegangspoort tot p38-signalering en neuropathische pijn. J Neurosci. 2008;28:2892-2902. [PubMed]
Kwan KY, Allchorne AJ, Vollrath MA, Christensen AP, Zhang DS, Woolf CJ, Corey DP. TRPA1 draagt bij aan koude, mechanische en chemische nociceptie, maar is niet essentieel voor haarceltransductie. neuron. 2006;50:277-289. [PubMed]
Kwan KY, Glazer JM, Corey DP, Rice FL, Stucky CL. TRPA1 moduleert mechanotransductie in huidsensorische neuronen. J Neurosci. 2009;29:4808-4819. [PMC gratis artikel] [PubMed]
Latremoliere A, Woolf CJ. Centrale sensitisatie: een generator van overgevoeligheid voor pijn door centrale neurale plasticiteit. J Pijn. 2009;10:895-926. [PMC gratis artikel] [PubMed]
Lawson JJ, McIlwrath SL, Woodbury CJ, Davis BM, Koerber HR. TRPV1 is in tegenstelling tot TRPV2 beperkt tot een subset van mechanisch ongevoelige cutane nociceptoren die reageren op warmte. J Pijn. 2008;9:298-308. [PMC gratis artikel] [PubMed]
Leffler A, Linte RM, Nau C, Reeh P, Babes A. Een hoogdrempelig door warmte geactiveerd kanaal in gekweekte ganglionneuronen van de dorsale wortel van de rat lijkt op TRPV2 en wordt geblokkeerd door gadolinium. Eur J Neurosci. 2007;26:12–22. [PubMed]
Liedtke W, Choe Y, Marti-Renom MA, Bell AM, Denis CS, Sali A, Hudspeth AJ, Friedman JM, Heller S. Vanilloid-receptor-gerelateerd osmotisch geactiveerd kanaal (VR-OAC), een kandidaat-osmoreceptor van gewervelden. Cel. 2000;103:525-535. [PMC gratis artikel] [PubMed]
Liedtke W, Friedman JM. Abnormale osmotische regulatie bij trpv4-/-muizen. Proc Natl Acad Sci VS A. 2003; 100: 13698-13703. [PMC gratis artikel] [PubMed]
Lin YW, Cheng CM, Leduc PR, Chen CC. Inzicht in sensorische zenuwmechanotransductie door gelokaliseerde elastomere matrixcontrole. PLoS One. 2009, 4: e4293. [PMC gratis artikel] [PubMed]
Lindia JA, McGowan E, Jochnowitz N, Abbadie C. Inductie van CX3CL1-expressie in astrocyten en CX3CR1 in microglia in het ruggenmerg van een rattenmodel van neuropathische pijn. J Pijn. 2005;6:434-438. [PubMed]
Liu XJ, Gingrich JR, Vargas-Caballero M, Dong YN, Sengar A, Beggs S, Wang SH, Ding HK, Frankland PW, Salter MW. Behandeling van inflammatoire en neuropathische pijn door Src los te koppelen van het NMDA-receptorcomplex. Nat Med. 2008;14:1325-1332. [PMC gratis artikel] [PubMed]
Lumpkin EA, Caterina MJ. Mechanismen van sensorische transductie in de huid. Natuur. 2007;445:858–865. [PubMed]
Luo ZD, Chaplan SR, Higuera ES, Sorkin LS, Stauderman KA, Williams ME, Yaksh TL. Opregulatie van de dorsale wortelganglion (alpha) 2 (delta) calciumkanaalsubeenheid en de correlatie ervan met allodynie bij ratten met spinale zenuwletsel. J Neurosci. 2001;21:1868-1875. [PubMed]
Macpherson LJ, Dubin AE, Evans MJ, Marr F, Schultz PG, Cravatt BF, Patapoutian A. Schadelijke verbindingen activeren TRPA1-ionkanalen door covalente modificatie van cysteïnes. Natuur. 2007;445:541-545. [PubMed]
Madrid R, de la Pena E, Donovan-Rodriguez T, Belmonte C, Viana F. Variabele drempel van trigeminus koude-thermogevoelige neuronen wordt bepaald door een balans tussen TRPM8 en Kv1 kaliumkanalen. J Neurosci. 2009;29:3120-3131. [PubMed]
Malan TP, Mata HP, Porreca F. Spinal GABA (A) en GABA (B) -receptorfarmacologie in een rattenmodel van neuropathische pijn. Anesthesiologie. 2002; 96: 1161-1167. [PubMed]
Malmberg AB, Chen C, Tonegawa S, Basbaum AI. Behoud van acute pijn en verminderde neuropathische pijn bij muizen zonder PKCgamma. Wetenschap. 1997;278:279-283. [PubMed]
Mandadi S, Sokabe T, Shibasaki K, Katanosaka K, Mizuno A, Moqrich A, Patapoutian A, Fukumi-Tominaga T, Mizumura K, Tominaga M. TRPV3 in keratinocyten verzendt temperatuurinformatie naar sensorische neuronen 2009 [PMC gratis artikel] [PubMed]
Materazzi S, Nassini R, Andre E, Campi B, Amadesi S, Trevisani M, Bunnett NW, Patacchini R, Geppetti P. Cox-afhankelijke vetzuurmetabolieten veroorzaken pijn door activering van de irriterende receptor TRPA1. Proc Natl Acad Sci VS A. 2008;105:12045–12050. [PMC gratis artikel] [PubMed]
Matta JA, Cornett PM, Miyares RL, Abe K, Sahibzada N, Ahern GP. Algemene anesthetica activeren een nociceptief ionkanaal om pijn en ontsteking te versterken. Proc Natl Acad Sci VS A. 2008;105:8784-8789. [PMC gratis artikel] [PubMed]
McKemy DD, Neuhausser WM, Julius D. Identificatie van een koude receptor onthult een algemene rol voor TRP-kanalen bij thermosensatie. Natuur. 2002;416:52-58. [PubMed]
McMahon SB, Bennett DLH, Bevan S. Inflammatoire mediatoren en modulatoren van pijn. In: McMahon SB, Koltzenburg M, redactie. Wall en Melzack's leerboek van Pain. Elsevier; 2008. blz. 49-72.
Melzack R, Wall PD. Pijnmechanismen: een nieuwe theorie. Wetenschap. 1965;150:971-979. [PubMed]
Messinger RB, Naik AK, Jagodic MM, Nelson MT, Lee WY, Choe WJ, Orestes P, Latham JR, Todorovic SM, Jevtovic-Todorovic V. In vivo silencing van de Ca(V)3.2 T-type calciumkanalen in sensorische neuronen verlicht hyperalgesie bij ratten met door streptozocine geïnduceerde diabetische neuropathie. Pijn. 2009;145:184-195. [PMC gratis artikel] [PubMed]
Milligan ED, Sloane EM, Watkins LR. Glia bij pathologische pijn: een rol voor fractalkine. J Neuro-immunol. 2008;198:113-120. [PMC gratis artikel] [PubMed]
Milligan ED, Zapata V, Chacur M, Schoeniger D, Biedenkapp J, O'Connor KA, Verge GM, Chapman G, Green P, Foster AC, et al. Bewijs dat exogene en endogene fractalkine spinale nociceptieve facilitatie bij ratten kan induceren. Eur J Neurosci. 2004;20:2294–2302. [PubMed]
Miraucourt LS, Dallel R, Voisin DL. Glycine-remmende disfunctie maakt aanraking tot pijn door PKCgamma-interneuronen. PLoS One. 2007, 2: e1116. [PMC gratis artikel] [PubMed]
Mochizuki T, Sokabe T, Araki I, Fujishita K, Shibasaki K, Uchida K, Naruse K, Koizumi S, Takeda M, Tominaga M. Het TRPV4-kationkanaal bemiddelt door stretch opgewekte Ca2+-instroom en ATP-afgifte in primaire urotheelcelculturen. J Biol Chem. 2009;284:21257–21264. [PMC gratis artikel] [PubMed]
Moore KA, Kohno T, Karchewski LA, Scholz J, Baba H, Woolf CJ. Gedeeltelijke perifere zenuwbeschadiging bevordert een selectief verlies van GABAerge remming in de oppervlakkige dorsale hoorn van het ruggenmerg. J Neurosci. 2002;22:6724-6731. [PubMed]
Mueller KL, Hoon MA, Erlenbach I, Chandrashekar J, Zuker CS, Ryba NJ. De receptoren en coderende logica voor bittere smaak. Natuur. 2005;434:225-229. [PubMed]
Muraki K, Iwata Y, Katanosaka Y, Ito T, Ohya S, Shigekawa M, Imaizumi Y. TRPV2 is een component van osmotisch gevoelige kationkanalen in aorta-myocyten van muis. Circa res. 2003;93:829-838. [PubMed]
Nagata K, Duggan A, Kumar G, Garcia-Anoveros J. Nociceptor en haarceltransducereigenschappen van TRPA1, een kanaal voor pijn en gehoor. J Neurosci. 2005;25:4052-4061. [PubMed]
Nagy I, Rang H. Schadelijke hitte activeert alle capsaïcine-gevoelige en ook een subpopulatie van capsaïcine-ongevoelige dorsale wortelganglionneuronen. Neurowetenschap. 1999;88:995-997. [PubMed]
Nassar MA, Levato A, Stirling LC, Wood JN. Neuropathische pijn ontwikkelt zich normaal bij muizen die zowel Na (v) 1.7 als Na (v) 1.8 missen. Mol Pain. 2005, 1: 24. [PMC gratis artikel] [PubMed]
Nassar MA, Stirling LC, Forlani G, Baker MD, Matthews EA, Dickenson AH, Wood JN. Nociceptor-specifieke gendeletie onthult een belangrijke rol voor Nav1.7 (PN1) bij acute en inflammatoire pijn. Proc Natl Acad Sci VS A. 2004;101:12706-12711. [PMC gratis artikel] [PubMed]
Neumann S, Braz JM, Skinner K, Llewellyn-Smith IJ, Basbaum AI. Onschadelijke, niet schadelijke input activeert PKCgamma interneuronen van de spinale dorsale hoorn via gemyeliniseerde afferente vezels. J Neurosci. 2008;28:7936-7944. [PMC gratis artikel] [PubMed]
Nichols ML, Allen BJ, Rogers SD, Ghilardi JR, Honore P, Luger NM, Finke MP, Li J, Lappi DA, Simone DA, et al. Overdracht van chronische nociceptie door spinale neuronen die de stof P-receptor tot expressie brengen. Wetenschap. 1999; 286:1558-1561. [PubMed]
Noel J, Zimmermann K, Busserolles J, Deval E, Alloui A, Diochot S, Guy N, Borsotto M, Reeh P, Eschalier A, et al. De mechanisch geactiveerde K+ kanalen TRAAK en TREK-1 regelen zowel de warme als de koude perceptie. EMBO J. 2009;28:1308–1318. [PMC gratis artikel] [PubMed]
Obata K, Katsura H, Miyoshi K, Kondo T, Yamanaka H, Kobayashi K, Dai Y, Fukuoka T, Akira S, Noguchi K. Toll-like receptor 3 draagt bij tot spinale gliale activering en tactiele allodynie na zenuwbeschadiging. J Neurochem 2008 [PubMed]
Olausson H, Cole J, Rylander K, McGlone F, Lamarre Y, Wallin BG, Kramer H, Wessberg J, Elam M, Bushnell MC, et al. Functionele rol van niet-gemyeliniseerde tactiele afferenten in de menselijke harige huid: sympathische respons en perceptuele lokalisatie. Exp Brain Res. 2008;184:135-140. [PubMed]
Pagina AJ, Brierley SM, Martin CM, Martinez-Salgado C, Wemmie JA, Brennan TJ, Symonds E, Omari T, Lewin GR, Welsh MJ, et al. Het ionkanaal ASIC1 draagt bij aan de viscerale maar niet aan de cutane mechanoreceptorfunctie. Gastro-enterologie. 2004;127:1739–1747. [PubMed]
Peier AM, Moqrich A, Hergarden AC, Reeve AJ, Andersson DA, Story GM, Earley TJ, Dragoni I, McIntyre P, Bevan S, et al. Een TRP-kanaal dat koude stimuli en menthol waarneemt. Cel. 2002a;108:705-715. [PubMed]
Peier AM, Reeve AJ, Andersson DA, Moqrich A, Earley TJ, Hergarden AC, Story GM, Colley S, Hogenesch JB, McIntyre P, et al. Een warmtegevoelig TRP-kanaal uitgedrukt in keratinocyten. Wetenschap. 2002b;296:2046-2049. [PubMed]
Perl ER. Ideeën over pijn, een historische kijk. Nat Rev Neurosci. 2007;8:71-80. [PubMed]
Petrus M, Peier AM, Bandell M, Hwang SW, Huynh T, Olney N, Jegla T, Patapoutian A. Een rol van TRPA1 in mechanische hyperalgesie wordt onthuld door farmacologische remming. Mol Pain. 2007, 3: 40. [PMC gratis artikel] [PubMed]
Polgar E, Hughes DI, Arham AZ, Todd AJ. Verlies van neuronen van laminas I-III van de spinale dorsale hoorn is niet vereist voor de ontwikkeling van tactiele allodynie in het gespaarde zenuwbeschadigingsmodel van neuropathische pijn. J Neurosci. 2005;25:6658-6666. [PubMed]
Porreca F, Ossipov MH, Gebhart GF. Chronische pijn en medullaire aflopende facilitering. Trends Neurosci. 2002;25:319–325. [PubMed]
Price MP, Lewin GR, McIlwrath SL, Cheng C, Xie J, Heppenstall PA, Stucky CL, Mannsfeldt AG, Brennan TJ, Drummond HA, et al. Het zoogdiernatriumkanaal BNC1 is vereist voor een normaal aanraakgevoel. Natuur. 2000;407:1007-1011. [PubMed]
Prijs MP, McIlwrath SL, Xie J, Cheng C, Qiao J, Tarr DE, Sluka KA, Brennan TJ, Lewin GR, Welsh MJ. Het DRASIC-kationkanaal draagt bij aan de detectie van huidaanraking en zure stimuli bij muizen. neuron. 2001;32:1071-1083. [PubMed]
Rau KK, Jiang N, Johnson RD, Cooper BY. Hittesensibilisatie in huid- en spiernociceptoren die verschillende combinaties van TRPV1- en TRPV2-eiwit tot expressie brengen. J Neurofysiol. 2007;97:2651-2662. [PubMed]
Rauck RL, Wallace MS, Burton AW, Kapural L, North JM. Intrathecale ziconotide voor neuropathische pijn: een overzicht. Pijn Praktijk. 2009;9:327-337. [PubMed]
Reid G, Flonta ML. Fysiologie. Koudstroom in thermoreceptieve neuronen. Natuur. 2001, 413: 480. [PubMed]
Ren K, Dubner R. Neuron-glia-overspraak wordt serieus: rol bij overgevoeligheid voor pijn. Curr Opin Anesthesie. 2008;21:570-579. [PMC gratis artikel] [PubMed]
Ritner HL, Machelska H, Stein C. Immuunsysteempijn en analgesie. In: Basbaum AI, Bushnell M, redactie. Wetenschap van pijn. 2009. blz. 407-427.
Roza C, Puel JL, Kress M, Baron A, Diochot S, Lazdunski M, Waldmann R. Knock-out van het ASIC2-kanaal bij muizen heeft geen invloed op cutane mechanosensatie, viscerale mechanonociceptie en gehoor. J Fysiol. 2004;558:659-669. [PMC gratis artikel] [PubMed]
Scherrer G, Imamachi N, Cao YQ, Contet C, Mennicken F, O'Donnell D, Kieffer BL, Basbaum AI. Dissociatie van de opioïde receptormechanismen die mechanische en hittepijn beheersen. Cel. 2009;137:1148-1159. [PMC gratis artikel] [PubMed]
Schmidt R, Schmelz M, Forster C, Ringkamp M, Torebjork E, Handwerker H. Nieuwe klassen van responsieve en niet-reagerende C-nociceptoren in de menselijke huid. J Neurosci. 1995;15:333-341. [PubMed]
Sivilotti L, Woolf CJ. De bijdrage van GABAA- en glycine-receptoren aan centrale sensitisatie: ontremming en door aanraking veroorzaakte allodynie in het ruggenmerg. J Neurofysiol. 1994;72:169–179. [PubMed]
Snider WD, McMahon SB. Pijn bij de bron aanpakken: nieuwe ideeën over nociceptoren. neuron. 1998;20:629-632. [PubMed]
Story GM, Peier AM, Reeve AJ, Eid SR, Mosbacher J, Hricik TR, Earley TJ, Hergarden AC, Andersson DA, Hwang SW, et al. ANKTM1, een TRP-achtig kanaal dat tot expressie wordt gebracht in nociceptieve neuronen, wordt geactiveerd door koude temperaturen. Cel. 2003;112:819-829. [PubMed]
Strotmann R, Harteneck C, Nunnenmacher K, Schultz G, Plant TD. OTRPC4, een niet-selectief kationkanaal dat gevoeligheid verleent voor extracellulaire osmolariteit. Nat Cell Biol. 2000;2:695–702. [PubMed]
Sugai E, Morimitsu Y, Iwasaki Y, Morita A, Watanabe T, Kubota K. Scherpe eigenschappen van sanshool-gerelateerde verbindingen geëvalueerd door een sensorische test en activering van TRPV1 bij ratten. Biosci Biotechnol Biochem. 2005; 69: 1951-1957. [PubMed]
Suzuki M, Watanabe Y, Oyama Y, Mizuno A, Kusano E, Hirao A, Ookawara S. Lokalisatie van mechanisch gevoelig kanaal TRPV4 in muishuid. Neurosci Lett. 2003; 353: 189-192. [PubMed]
Swayne LA, Bourinet E. Spanningsafhankelijke calciumkanalen bij chronische pijn: opkomende rol van alternatieve splicing. Pflugers Arch. 2008;456:459-466. [PubMed]
Takahashi A, Gotoh H. Mechanosensitieve hele celstromen in gekweekte somatosensorische neuronen van ratten. Hersenonderzoek. 2000; 869: 225-230. [PubMed]
Tanga FY, Nutile-McMenemy N, DeLeo JA. De CZS-rol van Toll-like receptor 4 bij aangeboren neuro-immuniteit en pijnlijke neuropathie. Proc Natl Acad Sci VS A. 2005; 102: 5856-5861. [PMC gratis artikel] [PubMed]
Tominaga M, Caterina MJ, Malmberg AB, Rosen TA, Gilbert H, Skinner K, Raumann BE, Basbaum AI, Julius D. De gekloonde capsaïcine-receptor integreert meerdere pijnproducerende stimuli. neuron. 1998;21:531-543. [PubMed]
Torsney C, MacDermott AB. Ontremming opent de poort naar pathologische pijnsignalering in oppervlakkige neurokinine 1-receptor tot expressie brengende neuronen in het ruggenmerg van ratten. J Neurosci. 2006;26:1833–1843. [PubMed]
Tozaki-Saitoh H, Tsuda M, Miyata H, Ueda K, Kohsaka S, Inoue K. P2Y12-receptoren in spinale microglia zijn vereist voor neuropathische pijn na perifere zenuwbeschadiging. J Neurosci. 2008;28:4949-4956. [PubMed]
Trevisani M, Siemens J, Materazzi S, Bautista DM, Nassini R, Campi B, Imamachi N, Andre E, Patacchini R, Cottrell GS, et al. 4-Hydroxynonenal, een endogeen aldehyde, veroorzaakt pijn en neurogene ontsteking door activering van de irriterende receptor TRPA1. Proc Natl Acad Sci VS A. 2007;104:13519–13524. [PMC gratis artikel] [PubMed]
Tsuda M, Shigemoto-Mogami Y, Koizumi S, Mizokoshi A, Kohsaka S, Salter MW, Inoue K. P2X4-receptoren geïnduceerd in spinale microglia-poort tactiele allodynie na zenuwbeschadiging. Natuur. 2003;424:778–783. [PubMed]
Ulmann L, Hatcher JP, Hughes JP, Chaumont S, Green PJ, Conquet F, Buell GN, Reeve AJ, Chessell IP, Rassendren F. Up-regulatie van P2X4-receptoren in spinale microglia na perifere zenuwbeschadiging medieert BDNF-afgifte en neuropathische pijn. J Neurosci. 2008;28:11263–11268. [PubMed]
Verge GM, Milligan ED, Maier SF, Watkins LR, Naeve GS, Foster AC. Fractalkine (CX3CL1) en fractalkinereceptor (CX3CR1) distributie in het ruggenmerg en dorsale wortelganglia onder basale en neuropathische pijncondities. Eur J Neurosci. 2004;20: 1150-1160. [PubMed]
Viana F, de la Pena E, Belmonte C. Specificiteit van koude thermotransductie wordt bepaald door differentiële ionkanaalexpressie. Nat Neurosci. 2002; 5: 254-260. [PubMed]
Wetzel C, Hu J, Riethmacher D, Benckendorff A, Harder L, Eilers A, Moshourab R, Kozlenkov A, Labuz D, Caspani O, et al. Een eiwit uit het stomatine-domein dat essentieel is voor het tastgevoel bij de muis. Natuur. 2007;445:206–209. [PubMed]
Woodbury CJ, Zwick M, Wang S, Lawson JJ, Caterina MJ, Koltzenburg M, Albers KM, Koerber HR, Davis BM. Nociceptoren zonder TRPV1 en TRPV2 hebben normale warmtereacties. J Neurosci. 2004;24:6410-6415. [PubMed]
Woolf CJ. Bewijs voor een centrale component van overgevoeligheid voor pijn na een blessure. Natuur. 1983;306:686-688. [PubMed]
Yagi J, Wenk HN, Naves LA, McCleskey EW. Aanhoudende stromen door ASIC3-ionkanalen bij de bescheiden pH-veranderingen die optreden tijdens myocardischemie. Circa res. 2006;99:501-509. [PubMed]
Jaksh TL. Gedrags- en autonome correlaten van de tactiele opgewekte allodynie geproduceerd door spinale glycine-remming: effecten van modulerende receptorsystemen en exciterende aminozuurantagonisten. Pijn. 1989;37:111-123. [PubMed]
Yang Y, Wang Y, Li S, Xu Z, Li H, Ma L, Fan J, Bu D, Liu B, Fan Z, et al. Mutaties in SCN9A, coderend voor een natriumkanaal-alfa-subeenheid, bij patiënten met primaire erythermalgie. J Med Genet. 2004;41:171-174. [PMC gratis artikel] [PubMed]
Zamponi GW, Lewis RJ, Todorovic SM, Arneric SP, Snutch TP. De rol van spanningsafhankelijke calciumkanalen in oplopende pijnpaden. Brain Res Rev. 2009;60:84-89. [PMC gratis artikel] [PubMed]
Zhuang ZY, Kawasaki Y, Tan PH, Wen YR, Huang J, Ji RR. De rol van de CX3CR1/p38 MAPK-route in spinale microglia voor de ontwikkeling van neuropathische pijn na door zenuwbeschadiging geïnduceerde splitsing van fractalkine. Hersengedrag Immuun. 2007;21:642-651. [PMC gratis artikel] [PubMed]
Zimmermann K, Leffler A, Babes A, Cendan CM, Carr RW, Kobayashi J, Nau C, Wood JN, Reeh PW. Sensorisch neuron natriumkanaal Nav1.8 is essentieel voor pijn bij lage temperaturen. Natuur. 2007;447:855-858. [PubMed]
Zurborg S, Yurgionas B, Jira JA, Caspani O, Heppenstall PA. Directe activering van het ionkanaal TRPA1 door Ca2+ Nat Neurosci. 2007;10:277-279. [PubMed]
Bijkomende onderwerpen: Rugpijn
Rugpijn is een van de meest voorkomende oorzaken van invaliditeit en gemiste dagen op het werk wereldwijd. Rugpijn is trouwens toegeschreven als de op één na meest voorkomende reden voor bezoeken aan artsenbureaus, die in de minderheid zijn dan alleen infecties aan de bovenste luchtwegen. Ongeveer 80 procent van de bevolking ervaart ten minste één keer gedurende hun hele leven een vorm van rugpijn. De wervelkolom is een complexe structuur bestaande uit botten, gewrichten, ligamenten en spieren, naast andere zachte weefsels. Vanwege dit, verwondingen en / of verergerde omstandigheden, zoals herniated discs, kan uiteindelijk leiden tot symptomen van rugpijn. Sportblessures of ongevallen met auto-ongelukken zijn vaak de meest voorkomende oorzaak van rugpijn, maar soms kunnen de eenvoudigste bewegingen pijnlijke resultaten hebben. Gelukkig kunnen alternatieve behandelingsopties, zoals chiropractische zorg, de rugpijn verlichten door het gebruik van spinale aanpassingen en handmatige manipulaties, waardoor uiteindelijk de pijnverlichting wordt verbeterd.

EXTRA BELANGRIJK ONDERWERP: Beheer van lage rugpijn
MEER ONDERWERPEN: EXTRA EXTRA: Chronische pijn en behandelingen
Disclaimer plaatsen
Professionele reikwijdte van de praktijk *
De informatie hierin over "Mechanismen van acute pijn versus chronische pijn" is niet bedoeld ter vervanging van een een-op-een relatie met een gekwalificeerde zorgverlener of gediplomeerde arts en is geen medisch advies. We moedigen u aan om beslissingen over de gezondheidszorg te nemen op basis van uw onderzoek en samenwerking met een gekwalificeerde zorgverlener.
Blog Informatie & Scope Discussies
Ons informatiebereik: is beperkt tot chiropractie, bewegingsapparaat, acupunctuur, fysieke medicijnen, welzijn, etiologische bijdragen viscerosomatische stoornissen binnen klinische presentaties, geassocieerde somatoviscerale reflex klinische dynamiek, subluxatiecomplexen, gevoelige gezondheidskwesties en/of functionele geneeskunde artikelen, onderwerpen en discussies.
Wij bieden en presenteren klinische samenwerking met specialisten uit verschillende disciplines. Elke specialist wordt beheerst door hun professionele praktijk en hun jurisdictie van licentiestatus. We gebruiken functionele gezondheids- en welzijnsprotocollen om de verwondingen of aandoeningen van het bewegingsapparaat te behandelen en te ondersteunen.
Onze video's, berichten, onderwerpen, onderwerpen en inzichten behandelen klinische zaken, problemen en onderwerpen die verband houden met en direct of indirect onze klinische praktijk ondersteunen.*
Ons kantoor heeft redelijkerwijs geprobeerd ondersteunende citaten te verstrekken en heeft de relevante onderzoeken geïdentificeerd die onze berichten ondersteunen. Wij verstrekken kopieën van ondersteunende onderzoeksstudies die op verzoek beschikbaar zijn voor regelgevende instanties en het publiek.
We begrijpen dat we zaken behandelen die een aanvullende uitleg vereisen over hoe het kan helpen bij een bepaald zorgplan of behandelprotocol; daarom, om het onderwerp hierboven verder te bespreken, aarzel dan niet om te vragen Dr. Alex Jimenez, DC, of neem contact met ons op 915-850-0900.
Wij zijn er om u en uw gezin te helpen.
zegeningen
Dr. Alex Jimenez DC MSACP, RN*, CCST, IFMCP*, CIFM*, ATN*
e-mail: coach@elpasofunctionalmedicine.com
Licentie als Doctor of Chiropractic (DC) in Texas & New Mexico*
Texas DC-licentie # TX5807, New Mexico DC-licentie # NM-DC2182
Gediplomeerd als geregistreerd verpleegkundige (RN*) in Florida
Florida-licentie RN-licentie # RN9617241 (controle nr. 3558029)
Compacte status: Licentie voor meerdere staten: Geautoriseerd om te oefenen in 40 Staten*
Momenteel geregistreerd: ICHS: MSN * FNP (Programma voor gezinsverpleegkundige)
Dr. Alex Jimenez DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Mijn digitale visitekaartje




 Nogmaals Wij Heten U Van harte Welkom¸
Nogmaals Wij Heten U Van harte Welkom¸
